Este artículo es parte de la edición de septiembre, 2019
Por qué es tan difícil el control de la Bronquitis Infecciosa
Aunque la bronquitis infecciosa – IB- se considera tradicionalmente como una enfermedad de las vías respiratorias superiores, algunas cepas del virus pueden causar inflamación de los riñones o disminuir la producción y la calidad de los huevos si infectan el oviducto de las gallinas.
MARK W. JACKWOOD Y J.R. GLISSON
Departamento de Medicina Aviar, Universidad de Georgia
Sin embargo, ésta no es la única forma en que el virus de la bronquitis infecciosa – IBV – causa pérdidas. El virus también predispone a los broilers a infecciones bacterianas secundarias, como Escherichia coli, lo que oirigina un desarrollo deficiente, mortalidad y decomisos en el matadero. El control del IBV, por lo tanto, no solo previene la enfermedad sino que también disminuye las infecciones bacterianas secundarias, lo que reduce significativamente los problemas de rendimiento y el uso de antibióticos en las aves. 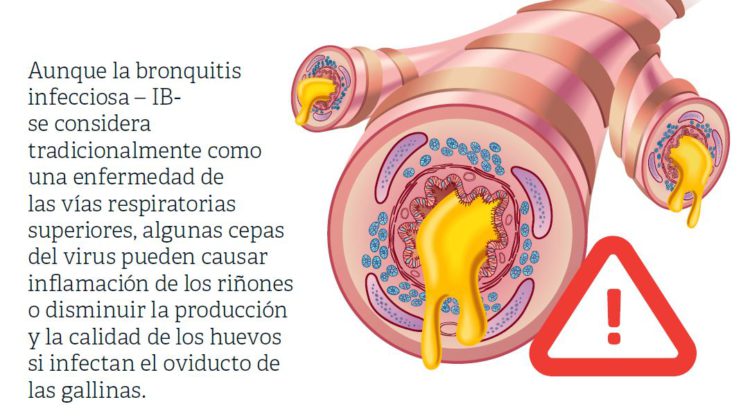
La mejor estrategia para el control del IBV es el empleo de vacunas vivas atenuadas en los broilers, junto con una combinación de vacunas vivas seguidas de otras muertas en los reproductores y las ponedoras. Sin embargo, como también es sabido, es difícil establecer una protección completa porque los diferentes tipos de IBV no tienen protección cruzada.
Si hubiera un número finito de tipos de IBV, podríamos hacer fácilmente unas vacunas contra cada uno. Pero nuevos tipos de IBV continúan emergiendo sin previo aviso, lo que dificulta mantenerse por delante de la enfermedad.La aparición de nuevos tipos de IBV se reduce a la capacidad del virus para cambiar rápidamente cuando se duplica. Esos nuevos tipos de IBV pueden evitar la respuesta inmune e infectar y replicarse incluso en aves previamente inmunizadas.

¿Cómo la replicación conduce a cambios del virus?
El IBV tiene un genoma de ARN monocatenario – conjunto de genes -. Por naturaleza, los virus de ARN cambian mucho más rápidamente que los virus de ADN. De hecho, los virus de ARN cambian tan rápido que realmente podemos medir su evolución molecular después de unos pocos pases en las aves.
Los cambios en el ARN viral se producen porque la proteína codificada por el virus – polimerasa ARN -, responsable de copiar el del virus, tiene un mecanismo de corrección muy deficiente. En consecuencia, cuando la polimerasa ARN comete un error, tiene problemas para volver atrás y solucionarlo.
Además, la polimerasa ARN viral es propensa a cometer errores. Estos errores se denominan mutaciones y cuando ocurren en lugares clave en el genoma del virus pueden dar lugar a la aparición de un nuevo tipo de virus. Mientras el virus sea libre de replicarse y transmitirse a aves nada o parcialmente protegidas, se acumularán mutaciones. Las mutaciones que proporcionan una ventaja de aptitud física persistirán y eventualmente originarán la aparición de un nuevo tipo de IBV capaz de infectar y causar enfermedades.
DERIVA GENÉTICA FRENTE A RECOMBINACIÓN
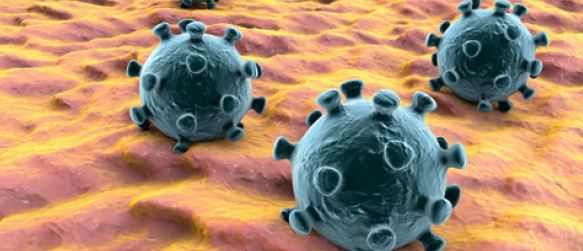
Hay una importante proteína estructural que se encuentra en todos los coronavirus, incluido el IBV. Se llama la espina o glicoproteína S. La glicoproteína S forma proyecciones en forma de pico en la superficie de las partículas del virus – figura 1 -.
La glicoproteína S se utiliza para identificar el tipo de IBV. Es responsable de la unión a las células huésped y de inducir el desarrollo de una respuesta inmune protectora en el ave.
En general, los nuevos tipos de IBV emergen a través de mutaciones en la glucoproteína S que se acumulan con el tiempo, lo que se conoce como deriva genética. Los coronavirus también pueden sufrir recombinaciones. Ahí es donde dos virus principales contribuyen con partes de su genoma para crear un nuevo virus quimérico. En términos más simples, un IBV quimérico es un nuevo virus que tiene una mezcla de genes de dos o más tipos diferentes de IBV.
El cambio genético que tiene lugar a partir de la recombinación puede ocurrir rápidamente, pero rara vez origina un nuevo tipo de IBV capaz de causar enfermedades debido a los mecanismos involucrados.
FIGURA 1. Partículas del virus de la bronquitis infecciosa infectan células epiteliales ciliadas en la tráquea. Las proyecciones en forma de palo en la superficie de las partículas son las glicoproteínas S. La sección transversal del virus, la partícula más grande, también muestra las proteínas de la membrana incrustadas en la envoltura viral, así como el ARN viral dentro de la partícula.
OPCIONES DE CONTROL DE LA IB
Está bien establecido que los IBV con proteínas de espina completamente diferentes no protegen de manera cruzada y que las vacunas vivas homólogas – similares – atenuadas proporcionan la mejor protección.
Como se indicó anteriormente, es imposible desarrollar vacunas atenuadas homólogas y vivas para todos los diferentes tipos de IBV que se encuentran en las aves. La protección cruzada a veces es posible, pero generalmente disminuye con la disminución de la similitud entre las glicoproteínas S. En otras palabras, mientras menor sea la similitud entre una vacuna y el tipo de IBV que circula en el campo, es menos probable que haya protección. A la inversa, hay varios factores que probablemente contribuyen a la protección cruzada. Una es la similitud de las regiones conservadas en las proteínas de pico entre los diferentes tipos de IBV y la capacidad de los anticuerpos que se unen a esas regiones conservadas para neutralizar el virus.
Otro factor probable es la fuerza de la respuesta inmune pues algunas vacunas provocan una respuesta inmunitaria más fuerte que otras, pero esto generalmente va acompañado de una fuerte reacción vacunal. Otros factores son el número de vacunaciones administradas, lo que fortalece la respuesta inmunitaria, así como la combinación de diferentes tipos de vacunas contra el IBV, que contribuyen a una respuesta de anticuerpos más amplia.La protección cruzada no puede predecirse con confianza y debe probarse en las aves. Una vez que se identifica el tipo de IBV que circula en el campo, podemos aprovechar la experiencia pasada para diseñar una estrategia de vacunación adecuada. Si el virus de campo es nuevo y, por lo tanto, no hay experiencia pasada a la que recurrir, entonces la secuencia de la glicoproteína del virus S de campo se puede usar para identificar vacunas con una secuencia de picos similar para pruebas en aves.
La «nueva» estrategia de la vacuna debe probarse en el laboratorio utilizando aves libres de patógenos específicos – SPF -, o en pruebas “de campo» al adoptar la nueva estrategia vacunal para la siguiente manada de aves.
Las pruebas de laboratorio son la mejor alternativa ya que las variables que pueden confundir el resultado de la prueba se mantienen al mínimo. Aunque no es difícil, requiere las instalaciones, el tiempo, el dinero y la experiencia adecuados.
Básicamente, las aves SPF se vacunan de acuerdo con la nueva estrategia que se adoptará, que se mantendrá durante un período de tiempo – generalmente 4 o 5 semanas – en unidades de aislamiento y luego se expondrá al virus de campo. Se evalúa la protección de las aves 5 días después de la exposición, examinándolas en busca de signos clínicos y lesiones típicas del IBV e intentando volver a aislar el virus de la prueba.
Es importante incluir grupos de control para verificar la validez del experimento. Idealmente, esta prueba se realizaría cada vez que se identifique una nueva variante del virus o cuando la estrategia de vacunación actual no esté funcionando.
Para el control del IBV es importante desarrollar una estrategia de vacunación con tipos de vacunas homólogas o con una combinación de tipos de vacunas heterólogas administradas varias veces ya que puede reducir la replicación del virus de campo a niveles inferiores de transmisión, lo que evita o al menos ralentiza la aparición de nuevos tipos de IBV, capaces de causar enfermedades.

RESUMEN
La bronquitis infecciosa es una enfermedad respiratoria altamente contagiosa en las aves, causada por el coronavirus aviar IBV. La enfermedad es difícil de controlar con la vacunación porque los diferentes tipos de virus, que no protegen de manera cruzada, continúan surgiendo en aves de corral comerciales.
Debido a que el IBV es un virus de ARN, puede cambiar muy rápidamente cuando se replica. Las mutaciones que se producen en el gen de la glicoproteína S pueden alterar la composición de esa proteína en la superficie del virus, lo que origina la aparición de nuevos tipos de IBV.
El uso de una vacuna que tenga una glucoproteína S idéntica al virus patógeno que causa la enfermedad en el campo es el mejor método para controlar el IBV. Pero como no contamos con vacunas contra todos los tipos de IBV circulantes, una combinación de diferentes tipos de IBV en la misma vacunación a veces puede proporcionar suficiente protección cruzada para evitar la transmisión y la replicación, lo que disminuye las posibilidades de que surjan nuevos tipos de IBV.
Con el apoyo de:

Categorías

Clasificados
Leer
Un tribunal alemán resuelve que el sacrificio de los pollitos machos es legal
Leer
Huevos y pollos, motivos de fraude alimentario
Leer
¿Cuáles son las claves de la persistencia en la puesta?
Leer
Cataluña sancionará las entradas de activistas en granjas
Leer
La ONU relaciona el cambio climático y la dieta
Leer
 Revistas
Revistas Archivo
Archivo La revista de la industria
La revista de la industria











































 PDF
PDF