Este artículo es parte de la edición de diciembre, 2018
EL INEXORABLE AVANCE DE LA INFLUENZA AVIAR EN NORTEAMÉRICA Y EN EL MUNDO (I)
Miguel Ángel Márquez
DVM, MSc, PhD, Diplomate ACPV
Departamento de Medicina y Zootecnia Aviar
Facultad de Medicina Veterinaria y Zootecnia
Universidad Nacional Autónoma de México
Introducción

Edoardo Bellarmico Perroncito (1847-1936)
La influenza aviar, también denominada “gripe” aviar, designa a una enfermedad infecto-contagiosa viral que afecta a las aves domésticas, aunque posee potencial como para infectar a distintas especies de mamíferos terrestres como el ser humano, cerdos, caballos, gatos domésticos, felinos salvajes y mamíferos acuáticos como focas y ballenas. Fue descrita clínicamente por vez primera por el científico Edoardo Bellarmino Perroncito, en el Piamonte - noroeste de Italia - en 1878.(1)
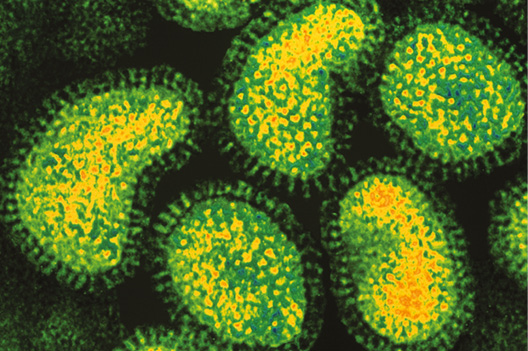
Virus de Influenza Aviar. Subtipo H5N1. Hong Kong, 1997.
Los virus de la influenza aviar forman parte del género iInfluenzavirus A de la familia Orthomyxoviridae. Son virus ARN segmentados de cadena negativa. Esta familia incluye varios virus clasificados en tres tipos: A, B y C, basándose en el carácter antigénico de una nucleoproteína interna. El tipo A es el único que puede provocar infecciones naturales en las aves domésticas, como gallinas, pavos, patos, gansos, pintadas, codornices, avestruces, etc. Los tipos B y C infectan principalmente al hombre y, ocasionalmente, al cerdo.
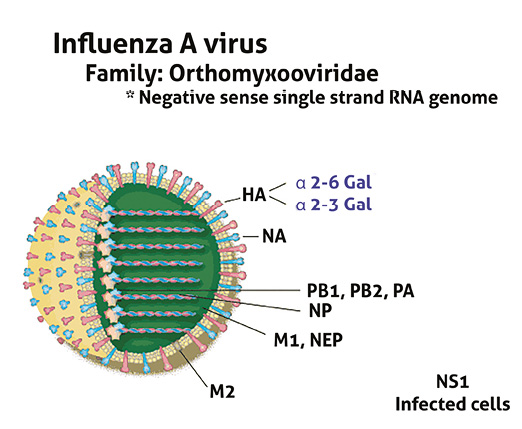
Anatomía de un virus de influenza Tipo A
La influenza aviar altamente patógena - IAAP - es una enfermedad viral causada fundamentalmente por los subtipos H5 y H7 del Tipo A del orthomyxovirus de la influenza, que afecta a la mayoría de las especies aviares - más de cien especies -, causando una enfermedad aguda de carácter congestivo-hemorrágico sistémico y extremadamente contagiosa, provocando una elevada mortalidad entre las 24-36 horas, en las explotaciones avícolas comerciales y que, por lo tanto, puede influir de un modo decisivo y catastrófico sobre la producción y comercialización de las aves y de los productos y subproductos avícolas de una región o de un país. En 1997, en Hong Kong, durante el brote causado por el virus subtipo H5N1 IAAP, se reveló su potencialidad de colonizar e infectar las mucosas epiteliales del aparato respiratorio e intestinal del hombre, siendo capaz de provocar su muerte.(2)
Los virus influenza de Tipo A se subdividen en subtipos basados en las dos glicoproteínas de superficie que poseen, la Hemoaglutinina y la Neuroaminidasa. Existen 16 tipos de hemoaglutininas y 9 tipos diferentes de neuroaminidasas, lo que favorece 144 combinaciones diferentes de H y N. Todos los subtipos son capaces de infectar a las aves, pero no de provocar la enfermedad. Hasta la fecha, todos los brotes de la forma hiperpatógena han sido causados únicamente por los subtipos H5 y H7.
Sin embargo, en el 2010 un grupo de investigadores del Centers for Disease Control and Prevention - CDC - de Atlanta, Georgia y el Center for Health Studies de la Universidad del Valle de Guatemala, identificaron sorprendentemente dos nuevas hemoaglutininas y dos nuevas neuroaminidasas: la H17 y la H18 y la N10 y la N11, de dos aislamientos de virus de influenza hechos a partir del Murciélago Pequeño de Hombros Amarillos - Sturnira lilium - en la selva guatemalteca: el H17N10 y el H18N11.(3)

Murciélago Pequeño de Hombros Amarillos (Sturnira lilium). Jungla guatemalteca
El inexorable avance de la influenza aviar en el mundo
Al paso de estas últimas décadas hemos observado, impotentes, el inexorable y preocupante avance de la influenza aviar en el mundo. En el continente americano, tenemos como antecedentes los catastróficos brotes causados por el virus tipo A, subtipo H5N2 de alta patogenicidad, que afectó a la avicultura industrial del noreste de Estados Unidos, particularmente la de los estados de Pennsylvania, Nueva Jersey y de la península del Delmarva - Delaware, Maryland y Virginia - en 1984. Dicho patógeno resurgiría diez años más tarde, afectando severamente a los productores avícolas de México entre 1994 y 1995. Además tuvimos del brote chileno del 2002, cuyo agente responsable fue un virus de influenza aviar de alta patogenicidad A/H7N3. Un antecedente más reciente ha sido la severa epizootia causada por el orthomyxovirus A/H7N3 de IAAP, que azotó la avicultura mexicana entre 2012 y 2013 y cuyo virus causal sigue aun circulando en los estados de Jalisco y Puebla.
Ahora bien, a nivel mundial hemos sido testigos de la panzootia provocada por el patógeno del subtipo H5N1 de alta patogenicidad, que apareció en Hong Kong en 1997 y que resurgió en China en el invierno del 2003, pasando a Europa y África y que preocupantemente, aun esta en curso en el sureste asiático a los diecinueve años de su inicio. Estos habían sido en resumen, los continuos y periódicos informes recibidos paulatinamente al paso del tiempo, de aislamientos en aves silvestres migratorias y de brotes en las aviculturas industriales en diversas partes del mundo y en particular en el continente americano.
El mencionado virus A/H5N1, de filogenia asiática, por vez primera mostró una capacidad de transmisión horizontal para infectar a seres humanos en estrecho contacto con aves domésticas en granjas avícolas y en mercados de aves vivas en Asia, particularmente en China; disparando las alarmas de la Organización Mundial de la Salud - OMS -. De los casos iniciales ocurridos en Hong Kong en 1997 al resurgimiento del orthomyxovirus A/H5N1 de origen aviar, ocurrido Asia en el 2003 hasta la fecha, el número de casos clínicos gripales y de muertes en seres humanos indicados por la OMS en Asia y África ha sido de 840, con 447 defunciones con una peligrosa y preocupante tasa de letalidad del 53,2 % a fines del 2015.(4)
Cronología del surgimiento de un nuevo patógeno
Durante el invierno 2013-2104 los servicios sanitarios veterinarios oficiales de Japón y de Corea del Sur, informaron de aislamientos virales a partir de aves silvestres, así como de brotes de influenza aviar en su avicultura industrial, causados por un virus H5N8 de IAAP.(5)
El virus ancestral que dio origen al mencionado patógeno, fue el A/goose/Guandong/GD01214 (H5)(6), que se encontraba en aves silvestres acuáticas en China durante la primavera del 2014 y que para el otoño se movilizó de los bosques boreales del Círculo Polar Ártico, de donde fue vehiculizado por medio de patos y gansos silvestres a Europa y a Alaska, en donde provocó brotes de influenza en aves domésticas Alemania, Países Bajos e Inglaterra a fines del 2014.
Simultáneamente en Beringia, el mencionado virus H5N8 altamente patogénico de filogenia euro-asiática, se recombina a través de un proceso redistribución genómica, con un virus H5N2 de baja patogenicidad de origen americano, surgiendo así el novel agente H5N2 de IAAP, que se distribuye en la zona fronteriza que ocupa el suroeste de Canadá y el noroeste de Estados Unidos a lo largo del corredor aéreo de migración de aves acuáticas silvestres del Pacífico.(7)
Disección molecular del nuevo virus EA/AM H5N2 IAAP
Durante este mecanismo de intercambio de material genético, el virus H5N8 de IAAP euro-asiático aportó cinco genes:
- 1.- Hemoaglutinina (H5)
- 2.- Proteína Matrix (M)
- 3.- Proteína Polimerasa Acídica Subunitaria 1 (PBI)
- 4.- Proteína Polimerasa Básica Subunitaria 2 (PB2)
- 5.- Proteína No Estructurada (NS)
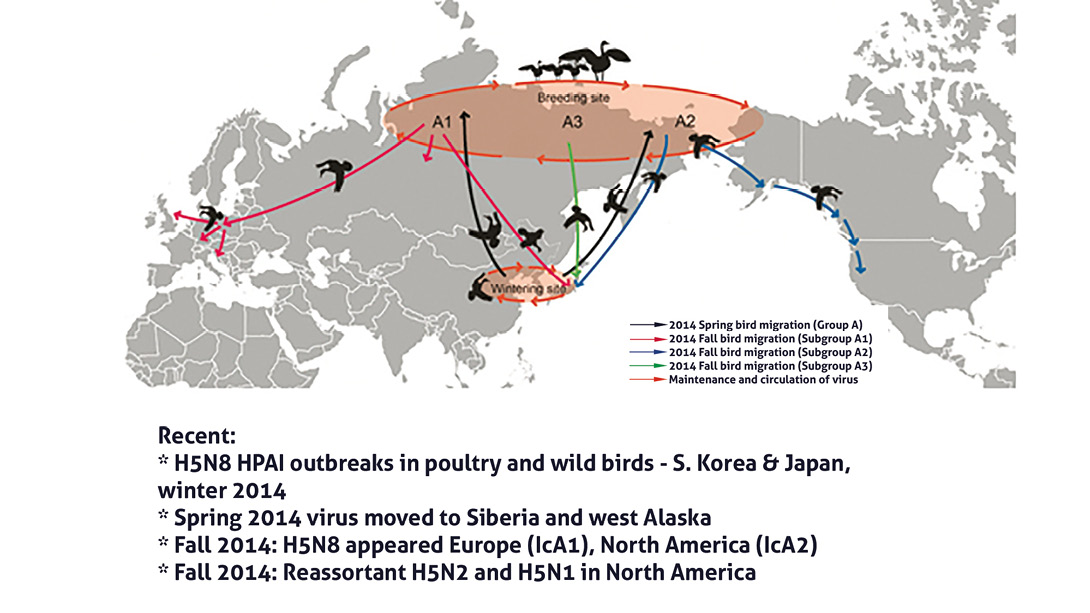
Surgimiento y desplazamiento del virus H5N8 de Influenza Aviar de Alta Patogenicidad de filogenia euro-asiática y su recombinación genética con el virus H5N2 de Baja Patogenicidad de origen americano en el otoño del 2014. (D. Swayne et al)
En tanto que, el virus H5N2 de IABP de linaje americano procedente de aves acuáticas norteamericanas contribuyó con tres genes:
- 1.- Neuroaminidasa (NA2)
- 2.- Núcleoproteína (NP)
- 3.- Proteína PA (PA)
Surgiendo de esta manera, un novel virus híbrido recombinante emergente perteneciente a la clada H5: 2.3.4.4.8
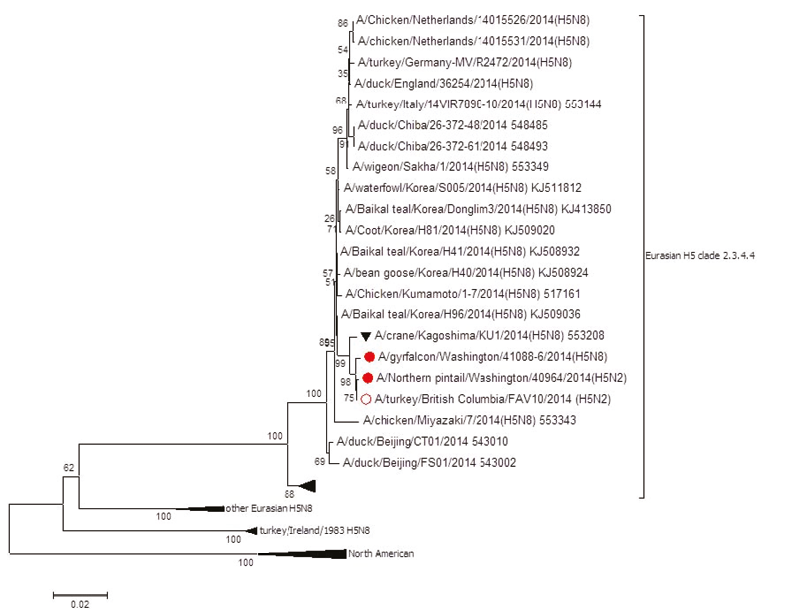
Árbol filogenético de la hemoaglutinina H5:
Clada 2.3.3.4. del virus EA-AM H5N2 IAAP,
que causó la epizootia de Influenza Aviar en
la avicultura de los Estados Unidos durante
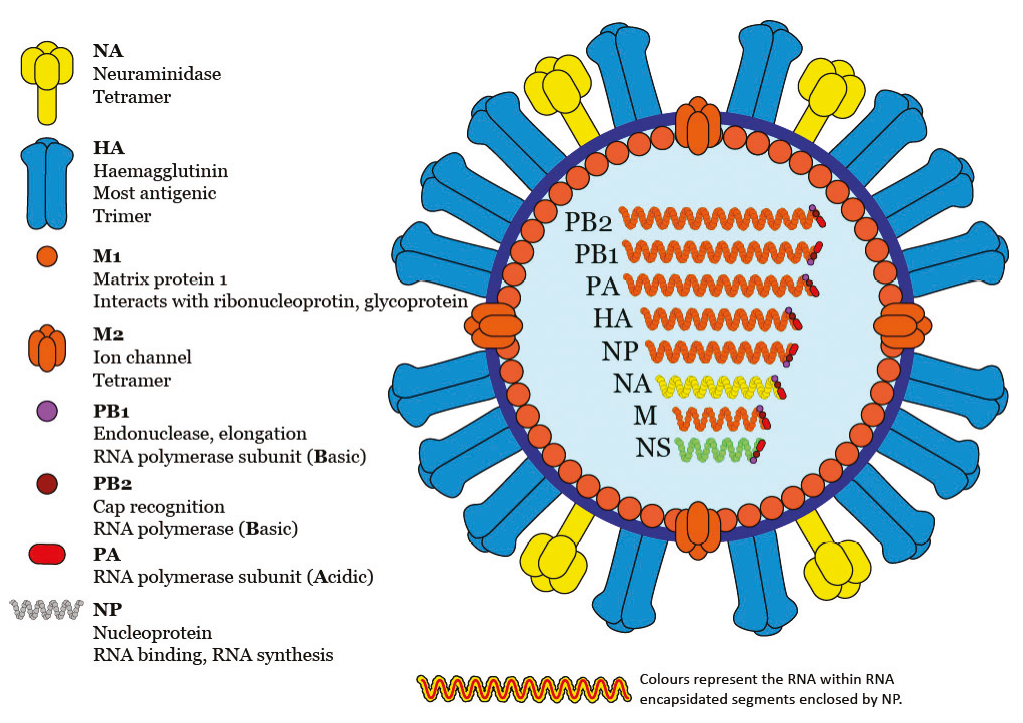
Estructura molecular característica de los orthomyxovirus de la influenza aviar. Nótese que el genoma viral esta subdividido en ocho segmentos, con los
genes PB2, PB1, PA, HA, NP, NA, M y NS.
---
1PERRONCITO, E. (1878). "Epizoozia tifoide nei galliancei." Annali della Academia d'agricoltora di Torino 21, 87-126. Italia.
2GREGER, MICHAEL. “Bird Flu. A virus of our own hatching”. Lantern Books. USA. 2006.
3SUXIANG Tong et al. “A distinct lineage of Influenza A virus from Bats”. PANS. 2012.
4Cumulative number of confirmed human cases for Avian Influenza A (H5N1) reported to the World Health Organization 2003-2015.
5Highly Pathogenic Avian Influenza A(H5N8) Virus from Waterfowl, South Korea, 2014. WHO/GIP. 2015.
6SMITH, GJ et al. Nomenclature updates resulting from the evolution of avian influenza A (H5) virus clades 2.1.3.2a, 2.2.1, and 2.3.4 during 2013-2014. Influenza Other Respir. Viruses. Sep; 9 (5): 271-6. doi: 10.1111/irv.12324.
7LEE DH, Torchetti MK, Winker K, Song CS, Swayne D. Intercontinental spread of Asian-origin H5N8 to North America through Beringia by Migratory Birds. J.Virology. 2015.
8HON S., Mia Kim Torchetti, Rocío Crespo et al. Novel Eurasian Highly Pathogenic Avian Influenza AH5 viruses in wild birds. Washington, USA. 2014. Emerging Infectious Disease Journal. Vol. 21. No 5. May, 2015.
Con el apoyo de:

Categorías

La Real Escuela de Avicultura OPINA: De Startups avícolas y no tan extraños compañeros de cama
Leer
Publicidad Big Dutchman
Leer
Publicidad Vencomatic Group
Leer
Publicidad Suscripciones Selecciones Avícolas
Leer
Índice de artículos/noticias publicados en Selecciones Avícolas en 2018
Leer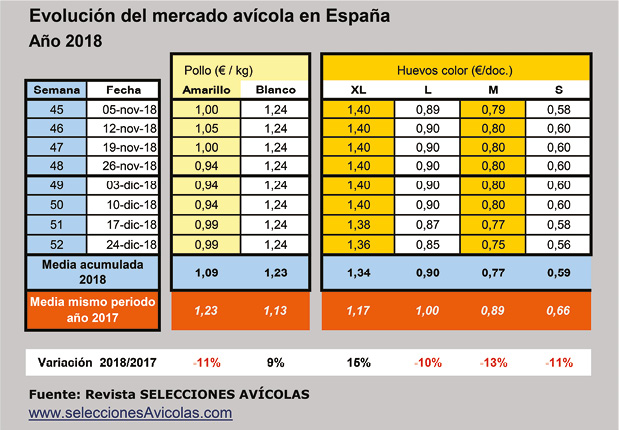
Mercados Avícolas: Balance del año
Leer
 Revistas
Revistas Archivo
Archivo La revista de la industria
La revista de la industria











































 PDF
PDF