Este artículo es parte de la edición de noviembre, 2016
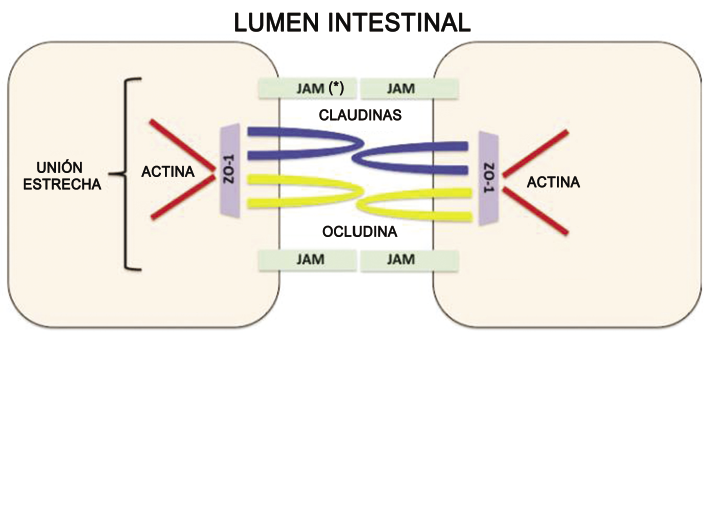
Fig. 1. Esquema de los componentes de las uniones estrechas –tight junctions; TJ-. Imagen modificada de Hammer y col., 2015.
(*) JAM -Moléculas de adhesión celular-.
Introducción
El epitelio intestinal puede representar una de las principales puertas de entrada de microorganismos patógenos hacia el interior del organismo. Por tanto, una adecuada salud intestinal permitirá al intestino cumplir con su función fisiológica de absorción de nutrientes a la vez que maniene controlado el paso de antígenos provenientes de los microorganismos presentes en la luz intestinal.
Este control en el paso de moléculas a través del epitelio intestinal se conoce como barrera intestinal, compuesta por distintos niveles o componentes. Entre estos componentes de la función barrera destacan factores luminales como enzimas digestivas, inmunoglobulinas, péptidos antimicrobianos y la propia microbiota comensal. También es un factor importante la capa de moco secretada por las células caliciformes del epitelio intestinal, que dificulta la adhesión de patógenos sobre la superficie epitelial y, por tanto, su entrada hacia el medio interno. El propio epitelio es un componente esencial, actuando no sólo como una barrera física formada por los enterocitos unidos mediante uniones intercelulares, sino como un actor activo en la regulación de otros componentes tales como el sistema inmune, el sistema nervioso entérico e incluso la microbiota intestinal. El epitelio intestinal debe, por tanto, mantener un control sobre su permeabilidad, regulando el paso de moléculas por vía transcelular o paracelular para cumplir con su función de absorción de nutrientes, pero también mantener un paso controlado de antígenos, evitando la entrada de patógenos que comprometan la salud intestinal y del animal en conjunto.
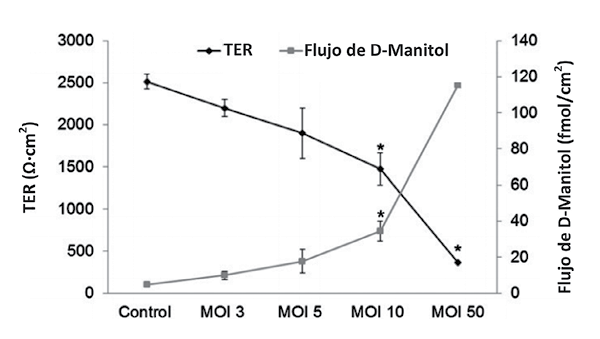
Fig. 2. Resistencia transepithelial -TER- y flujo de D-manitol en células Caco-2 infectadas con Salmonella Enteritidis -3 h de incubación- a diferentes niveles de multiplicidad de infección -MOI-. *: P < 0.05 vs. Control. -Brufau y col., 2016-
Uno de los componentes esenciales en el control de la permeabilidad paracelular del epitelio intestinal, son las uniones estrechas -en inglés tight junction; TJ-. Las TJ están formadas por proteínas transcelulares como ocludina, claudinas y proteínas JAM, y por proteínas intracelulares como Zonula Occludens –ZO- -1, -2 y -3 -figura 1-. Estas últimas unen las proteínas transcelulares con un anillo de actomiosina del enterocito, que se contrae por acción de quinasas, permitiendo así la apertura del espacio paracelular, y causando un aumento de la permeabilidad del epitelio.
Cuando se produce una disfunción de la barrera intestinal tiene lugar una activación del sistema inmune por el contacto excesivo e incontrolado de éste con factores luminales antigénicos -Patel y McCormick 2014; Sartor 1997-, conduciendo a una activación de respuestas inflamatorias, que rompen la homeostasis intestinal, perjudicando la salud intestinal. Esto comprometería los procesos de absorción de nutrientes de la dieta, pudiendo afectar negativamente el rendimiento productivo del animal, así como el estatus sanitario de las explotaciones por el aumento de la susceptibilidad a la aparición de patologías infecciosas.
Uno de los factores más importantes de disfunción de la barrera epitelial son las enterobacterias patógenas como Salmonella spp. Éstas causan disfunción de la barrera epitelial con el objetivo de facilitar la colonización intestinal. La Salmonella Typhimurium, además de causar cambios en la distribución de ZO-1, activa mecanismos para causar la contracción del polo apical de la célula -Brufau y col. 2015, 2016; Sears 2000- y, por tanto, aumentar la permeabilidad del epitelio intestinal. En estos estudios, la infección de cultivos celulares con Salmonella spp. aumenta la permeabilidad a macromoléculas -D-manitol- y reduce la resistencia transepithelial -Fig. 2-, lo que sugiere un deterioro de la función barrera intestinal tras la infección por esta enterobacteria -Brufau y col. 2016- y, en consecuencia, apunta hacia un deterioro de la salud intestinal.
La promoción de la salud intestinal ha sido una de las estrategias más relevantes para mantener el estatus sanitario de las aves y para la mejora de los rendimientos productivos de las mismas, principalmente desde la prohibición en la UE de los antibióticos como promotores de crecimiento. Los productos en base a β-galactomananos vegetales hidrolizables –βGMH- como es SALMOSAN®, desarrollado por ITPSA, tienen como objetivo esta mejora de la salud intestinal a través de distintos mecanismos, los cuales han sido evaluados tanto en estudios in vitro, como in vivo.
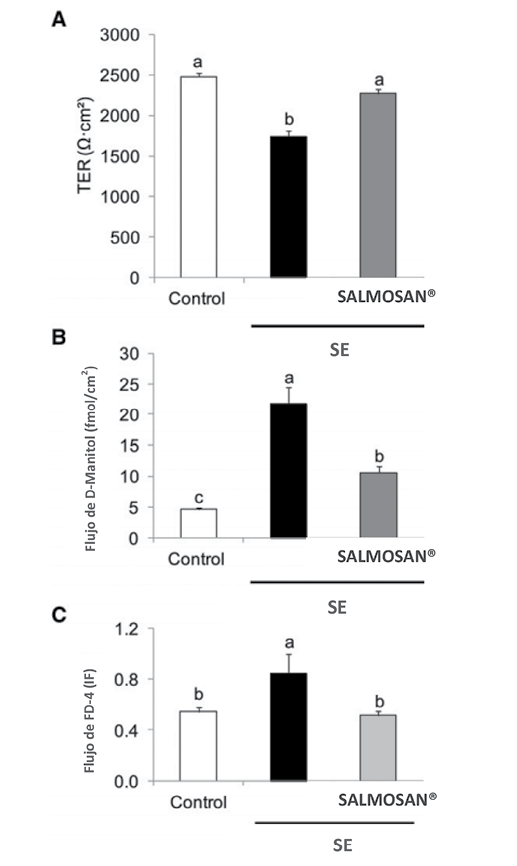
Fig. 3. Efecto protector de SALMOSAN® -500 µg/mL- en la función barrera epitelial de cultivos celulares Caco-2 infectados con Salmonella Enteritidis -3 h de incubación; MOI 10-. Resistencia transepithelial -TER; A-, flujo de D-manitol -B- y dextrano de isotiocianato de fluoresceína -FD-4; C-. n = 12-15 monocapas por grupo. Las letras distintas indican significación estadística -P < 0.05- IF: Intensidad de fluorescencia. SE: Salmonella Enteritidis. -Brufau y col., 2016-
La integridad de la barrera intestinal es esencial para preservar la salud de las aves
SALMOSAN® actúa sobre las enterobacterias, como Salmonella enterica y Escherichia coli enterotoxigénico -ETEC-, bloqueando sus fimbrias -Badia, Brufau, y col. 2012; Badia, Zanello, y col. 2012-, que constituyen uno de sus principales mecanismos de adhesión al epitelio, necesario para su colonización -Sharon y Lis 1993-, y promoviendo su eliminación en las heces sin capacidad infectiva.
En recientes estudios in vitro se ha confirmado que SALMOSAN® revierte los efectos negativos que la Salmonella Enteritidis causa sobre la función barrera epitelial. Brufau y col. -2016- observaron que la adición de 500 µg/mL en cultivos celulares Caco-2 infectados con Salmonella Enteritidis -MOI:10- aumenta la resistencia epitelial -TER- y reduce el flujo de macromoléculas -figura 3-, situando estos parámetros en niveles normales e indicando una mejora de la función barrera epitelial.
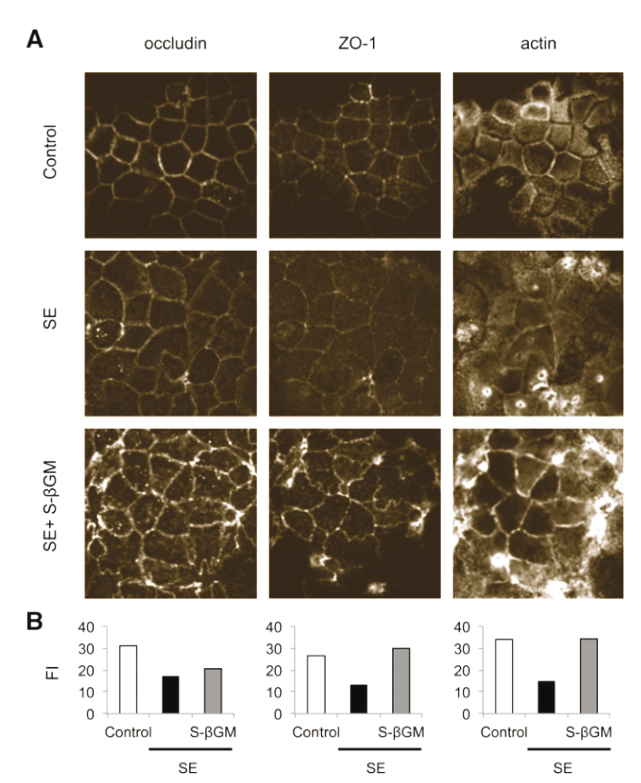
Figura 4. Efecto protector de SALMOSAN® -S-βGM; 500 µg/mL- en la función barrera epitelial de cultivos celulares Caco-2 infectados con Salmonella Enteritidis -3 h de incubación; MOI 10-. Resistencia transepithelial -TER; A-, flujo de D-manitol -B- y dextrano de isotiocianato de fluoresceína -FD-4; C-. Las letras distintas indican significación estadística -P < 0.05- FI: Intensidad de fluorescencia. SE: Salmonella Enteritidis. -Brufau y col., 2016-
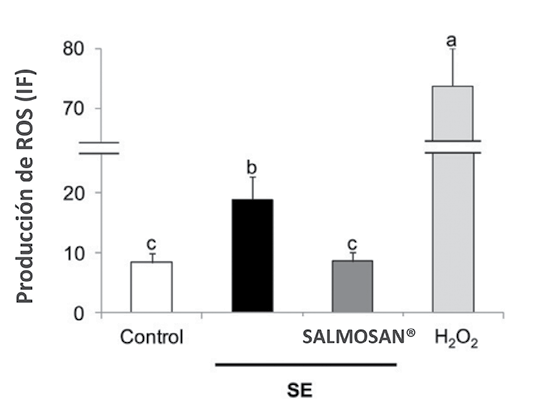
Figura 5. SALMOSAN® -S-βGM; 500 µg/mL- reduce la producción de especies reactivas de oxígeno (ROS) de cultivos celulares Caco-2 infectados con Salmonella Enteritidis -3 h de incubación; MOI 10-. n = 12 monocapas por grupo. Se utilizó H2O2 como control positivo. Las letras distintas indican significación estadística -P < 0.05- IF: Intensidad de fluorescencia. SE: Salmonella Enteritidis. -Brufau y col., 2016-
Con el objetivo de determinar los mecanismos subyacentes a los efectos funcionales observados en los cultivos celulares, Brufau y col. -2016- realizaron inmunofluorescencias de las proteínas relacionadas con las uniones estrechas ocludina -occludin- y Zonula occludens-1 -ZO-1-, así como de actina -figura 4-, componentes esenciales de la regulación de la permeabilidad epitelial y, por tanto, de la función barrera epitelial intestinal.
Como puede observarse en la figura 4, en condiciones normales, puede verse como el marcaje fluorescente correspondiente a estas proteínas se encuentra en la zona del borde celular. Sin embargo, la infección con Salmonella Enteritidis, además de reducir la intensidad del inmunomarcaje, altera este patrón de distribución de las proteínas evaluadas, induciendo una distribución de la ocludina más difusa y citoplasmática, y la formación de focos estelados en el caso del marcaje de actina -figura 4-.
La adición de SALMOSAN® al cultivo revirtió la reducción de la intensidad de fluorescencia de ocludina, ZO-1 y actina causada por Salmonella Enteritidis, recuperando en parte la distribución original de estas proteínas en la célula -figura 4-, pero persistiendo la presencia de marcaje citoplasmático de ocludina. De hecho, Marchiando y col. -2010- observaron que el aumento de la distribución citoplasmática de la ocludina persistía durante un tiempo prolongado después de la restauración de la función barrera intestinal. Por tanto, el ensamblaje de la unión estrecha y la distribución celular de las proteínas que la componen parecen estar detrás de los efectos protectores de los βGMH sobre la función barrera epitelial intestinal cuando existe infección por enterobacterias como Salmonella Enteritidis.
Por otra parte, los efectos beneficiosos de los βGMH sobre la salud intestinal no se limitan a la actividad protectora sobre la función barrera epitelial intestinal. Brufau y col. -2016- también demostraron que SALMOSAN® es capaz de revertir el aumento de especies reactivas de oxígeno causado por la infección por Salmonella Enteritidis y, por tanto, previniendo el daño oxidativo que perjudicaría la estructura y la funcionalidad del epitelio intestinal, en condiciones de infección por Salmonella.
Asimismo, SALMOSAN® posee efectos inmunomoduladores en condiciones de infección con Salmonella Typhimurium -Badia y col. 2014; Badia, Brufau, y col. 2012-, cosa que influye directamente sobre el mantenimiento de un buen estado de salud intestinal. En los trabajos de Badia y col. -2012 y 2014-, la infección de cultivos celulares -IPI-2I- con Salmonella Typhimurium induce un aumento en la expresión de citoquinas proinflamatorias -IL-6, IL-1α, TNFα and GM-CSF- y de quimiocinas -CXCL-2, -8 y -10, y CCL-2 y -20-por parte de las células epiteliales. La adición de SALMOSAN® en el medio no sólo previene el incremento en la expresión de marcadores inflamatorios causado por la infección con Salmonella Typhimurium, sino que también reduce algunos de estos marcadores de inflamación en ausencia del patógeno, favoreciendo la salud intestinal también en condiciones basales.
Estudios in vitro e in vivo confirman la eficacia de los β-galactomananos vegetales hidrolizables en la mejora de la salud intestinal de las aves
Los modelos in vitro e in vivo utilizados son una aproximación útil en el estudio de distintos aspectos que afectan la salud intestinal -función barrera epitelial, respuesta inmune, etc.- y permiten comprobar los beneficios que SALMOSAN® aporta sobre la misma. Para confirmar estos efectos en aves, en los últimos años se han llevado a cabo estudios in vivo, en los que se han obtenido resultados reveladores.
Brufau y col. -2015- demostraron en pollos que la inclusión de SALMOSAN® en la dieta aumentaba la secreción de moco intestinal por parte de las células caliciformes, no sólo respecto a los animales inoculados con 108 UFC Salmonella Enteritidis, sino también respecto a los controles no inoculados. Además, mediante microscopía electrónica, detectaron un mayor número de estas células caliciformes y una menor cantidad de bacterias adheridas al epitelio intestinal en aquellos animales que ingirieron SALMOSAN® en la dieta -figura 6-.
El aumento del grosor de la capa de moco por la adición de SALMOSAN® en la dieta podría dificultar que, tanto Salmonella spp., como otros patógenos, puedan adherirse al epitelio, facilitando su eliminación a través de las heces ya sin capacidad infectiva tras su unión a los βGMH. Por tanto, SALMOSAN® disminuye así el riesgo de infección y contribuye a un estado de salud intestinal óptimo en las aves.

Fig. 6. Microscopía electrónica del intestino de pollos: NC, no inoculación; PC: inoculación con 108 UFC de Salmonella enterica serovar Enteritidis. SA: inoculadas con Salmonella Enteritidis y con 1g/kg de β-galactomananos vegetales hidrolizados -SALMOSAN. Industrial Técnica Pecuaria, S.A.-. Todas las imágenes corresponden a íleo, excepto NC-B, SA-B, PC-C y PC-D, que corresponden a ciego. Las flechas negras indican bacterias adheridas al moco y a lamelipodios. Las flechas blancas señalan células caliciformes y la letra M indica células M. -Brufau y col., 2015-
La menor interacción patógeno-epitelio queda también evidenciada en este trabajo de Brufau y col. En condiciones de infección por Salmonella spp., y también por otras especies, diversos autores han descrito un aumento en el número de células epiteliales M –microfold cells- -Frost, Bland, & Wallis, 1997; Jepson y Clark, 1998; Brufau y col., 2015-. Estas células M tienen como principal cometido el transporte de antígenos de la luz intestinal al tejido linfoide de la mucosa mediante la formación de estructuras de membrana llamadas lamelipodios. Es sabido que las células M contribuyen al paso de Salmonella spp. a través de la pared intestinal tras adherirse mediante sus fimbrias. Por tanto, el menor número de células M, junto con una menor formación de lamelipodios, observado en las aves alimentadas con SALMOSAN®, es indicativo de una menor interacción de Salmonella enterica con el epitelio intestinal -figura 6-.
Coincidiendo con los estudios in vitro, Brufau y col. -2015- comprobaron mediante microscopía confocal que los animales infectados con Salmonella enterica muestran una desestructuración de las uniones estrechas causada por la deslocalización de la proteína ZO-1. Sin embargo, el consumo de SALMOSAN® por parte de las aves, previno estos efectos de Salmonella, mostrando una distribución de ZO-1 que coincide con la posición real de las TJ -figura 7-, y corroborando los estudios in vitro que demuestran la eficacia de SALMOSAN® en la promoción de la salud intestinal.
Asimismo, en ensayos realizados en el IRTA –Institut de Recerca i Tecnologia Agroalimentàries-, en los que pollos fueron alimentados con SALMOSAN®, se detectó que éstos eran capaces de inducir cambios en determinados receptores de tipo toll -TLR-. Los TLRs son esenciales en la activación y regulación de la respuesta inmune ya que reconocen patrones moleculares asociados a patógenos -PAMP, del inglés Pathogen-Associated Molecular Patterns-; por ejemplo, el lipopolisacárido -LPS- de la pared de bacterias Gram negativas -reconocido por TLR4-, el ácido lipoteicoico -LTA- de la pared de bacterias Gram positivas -detectado por TLR2-, o componentes de los flagelos de determinadas bacterias como Salmonella spp. -flagelina reconocida por TLR5-. En estas pruebas in vivo, se observó que la ingesta de SALMOSAN® incrementa la expresión de TLR2 en el ciego de pollos inoculados con Salmonella Typhimurium.
Por tanto, SALMOSAN® no sólo tiene efectos sobre estructuras esenciales en el control de la función barrera epitelial intestinal, sino que también influye sobre mecanismos implicados en el control de la respuesta inmune en condiciones in vivo, cosa que ya se ha demostrado en estudios in vitro.
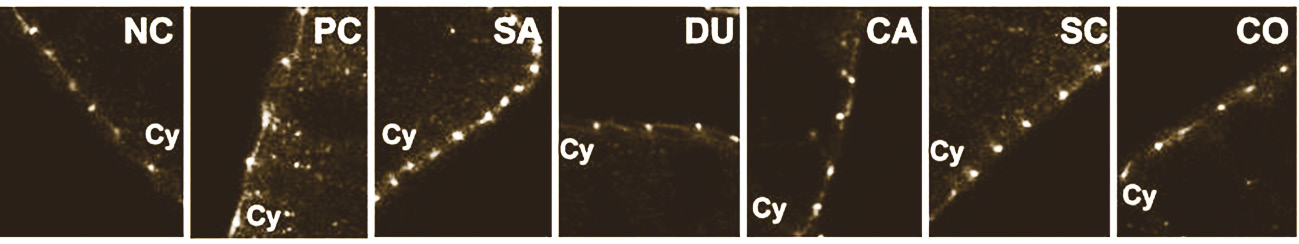
+ 1 g/kg SALMOSAN -Industrial Técnica Pecuaria, S.A.-. Cy: citosol. -Brufau y col., 2015-
Conclusiones
- La integridad de la función barrera intestinal es esencial para preservar la salud de las aves, reduciendo el riesgo de enfermedades infecciosas y contribuyendo al adecuado mantenimiento de las funciones fisiológicas intestinales.
- SALMOSAN® actúa uniéndose a las fimbrias de enterobacterias como Salmonella spp. y E. coli, bloqueando su mecanismo de adhesión al epitelio y evitando su colonización.
- Tanto en estudios in vitro, como in vivo, SALMOSAN® induce efectos beneficiosos para la promoción de la salud intestinal de las aves, mejorando la función barrera intestinal en condiciones de infección por enterobacterias como Salmonella.
- SALMOSAN® presenta un efecto inmunomodulador tanto en condiciones de exposición a patógenos, como en condiciones basales sin sobreexposición a los mismos. •
Con el apoyo de:

Categorías

EXAFAN avicultura de puesta A4
Leer
New Farms AD 201611
Leer
Mercados divergentes
Leer
La meteorología condiciona la cosecha en la UE
Leer
Clasificados noviembre 2016
Leer
Mejorando la puesta de la Castellana Negra en avicultura ecológica
Leer
 Revistas
Revistas Archivo
Archivo La revista de la industria
La revista de la industria