Este artículo es parte de la edición de junio, 2015
Medidas para una planta de incubación libre de salmonelas
Olivier León
Hubbard, Grupo Grimaud, Francia
La infección de las aves por salmonelas es un tema recurrente en todo el mundo por constituir tanto una amenaza para la salud animal comino para la pública. Una lucha eficiente contra la misma requiere conocer su biología, teniendo en cuenta que el género se puede dividir en dos grupos:
- Las salmonelas sin motilidad –SGP-, que comprenden la Salmonella gallinarum y pullorum, aunque algunos países no separan los dos serotipos. Este grupo pertenece al serogrupo D, y es un huésped específicos de las aves. Mientras que las gallináceas son el huésped natural, también se han descrito infecciones en otras especies, con variable sensibilidad a las mismas.
Estas salmonelas son responsable de la tifosis aviar y la pullorosis, una enfermedad crónica de las aves maduras y una infección aguda de los pollitos y los pavipollos, respectivamente. Este grupo de salmonelosis ha sido prácticamente erradicado a través de medidas adecuadas de manejo y análisis de sangre en muchos países como EE.UU., Canadá y Europa Occidental, aunque en otras partes del mundo todavía se enfrentan con pérdidas económicas relacionadas con ellas.
- Las salmonelas con motilidad –PTS-, a veces llamadas Salmonella paratifoidea, que no son específicas de un huésped y responsables de enfermedades transmitidas por los alimentos al ser humano a través de consumo de productos avícolas contaminados.
La creciente incidencia de salmonelosis en el ser humano ha sido el resultado del alto consumo de carne de ave y de la elevada prevalencia de Salmonellas en los manadas. Por ello se ha presionado por los organismos oficiales para que los productores avícolas controlen y monitoricen lasa infecciones por Salmonellas. En consecuencia, han sido elaboradas planes de control a nivel nacional para coordinar las acciones encaminadas a reducir la prevalencia de las infecciones, tanto en las aves de corral -especialmente las gallináceas y los pavos– como en el ser humano.
Dos ejemplos de este tipo de políticas se pueden encontrar, en Europa el Reglamento UE 200-20I0 para reproductores pesados y en Estados Unidos el Plan Nacional de Mejora Avícola. Por otra parte, la actual globalización del comercio avícola ha creado una nueva dimensión epidemiológica para la diseminación de la Salmonella y los países exportadores tienen que cumplir con las regulaciones específicas de los importadores respecto a ello.
Dada su naturaleza ubicua y la facilidad de tanto horizontal como vertical de transmisión, cualquier estrategia que tienda al objetivo de reducir la prevalencia de Salmonella debe abarcar todas las fases del proceso de producción.
El objetivo de este artículo es centrarse en las medidas para llevar a cabo a nivel de las salas de incubación para garantizar un status libre de Salmonella.
Paso 1: Identificación de las posibles fuentes
Este paso es obviamente crítico. Las fuentes de infección son múltiples y su importancia relativa puede variar mucho, dependiendo del contexto epidemiológica local: densidad de la granja, presencia de aves camperas, presencia de aves silvestres, prevalencia de la salmonela en el país y la existencia de un plan nacional de control.
La primera fuente a considerar son los huevos para incubar. La Salmonella puede transmitirse verticalmente a través de los mismos, pero también puede contaminar las membranas de la cáscara en el momento de la puesta y en el proceso de enfriamiento siguiente del huevo. La principal consecuencia es que un par de huevos infectados pueden propagar fácilmente la contaminación a toda la incubadora, así como a toda la nacedora durante la eclosión. Por lo tanto, la granja proveedora de los huevos debe proporcionar garantías sobre el estado sanitario de las manadas.
El agua utilizada en la incubadora es una fuente frecuente de infección. Si se utiliza un pozo o la red pública, la filtración de suelos contaminados en la fuente de agua es la principal forma de contaminación. El equipo contaminado -bandejas de huevos, zapatos, ruedas, etc.- también puede diseminar fácilmente las bacterias.
La Salmonella se puede llevar en el tracto digestivo o ser transportada mecánicamente por numerosos vertebrados, entre ellos roedores y aves silvestres. Del mismo modo, invertebrados como moscas, escarabajos o ácaros rojos pueden ser un riesgo potencial.
El ser humano pueden ser también una fuente de infección. El personal que trabaja en la planta de incubación es un riesgo, especialmente aquellos que tienen aves de corral o cerdos en sus casas, o bien han sufrido recientemente una intoxicación alimentaria sin un adecuado cuidado médico. El Centro para el Control de Enfermedades -EE.UU.- estima que por cada caso humano de infección positiva a salmonela, 29,3 casos no lo son.
La sala de incubación en sí puede ser el origen de la infección cuando ha habido una anterior contaminación que no se ha gestionado correctamente. Incluso si los huevos que se reciben provienen de manadas libres de salmonela, la contaminación tiene lugar durante el proceso de incubación.
Paso 2: Medidas específicas para hacer frente a las posibles fuentes
En la mayoría de los casos, una situación libre de salmonella se puede mantener mediante técnicas de manejo adecuadas. Repasemos las principales maneras de tratar con cada fuente potencial de contaminación antes mencionadas.
En los huevos para incubar, la mayoría de las medidas tienen, obviamente, que tomarse en la manada de reproductores, aunque algunas se pueden implementar en la planta de incubación. Un resumen de las puntos clave son los siguientes:
A nivel de la granja:
- Garantizar pollitos de un día procedentes de manadas libres de salmonela.
- Seguir un programa “todo dentro – todo fuera” y evitar las mezclas de edades dentro de una nave.
- Realizar un estricto control de plagas -aves silvestres, roedores, moscas y ácaros-.
- Utilizar piensos descontaminados, ya sea por tratamiento térmico o por el uso de acidificantes. Incluso si bien la granulación no puede ser considerada como un proceso de descontaminación, un pienso granulado es más seguro que otro en migajas o harina. El estado de la materia prima es de suma importancia y las proteínas de origen animal son un factor de riesgo bien conocido.
- Tener una implementación estricta en la entrada del personal y los cambios de ropa: tener calzado y gorros especiales para cada edificio.
- Tener un adecuado manejo de la cama: aquellas en mal estado favorecen la supervivencia de las salmonelas.
- En los países en lo que permite, la vacunación de las aves disminuye la sensibilidad de las aves a la infección. Tanto las vacunas vivas como las inactivadas se han desarrollado con diferentes objetivos. La inmunidad contra la Salmonella es tanto humoral como mediada por las células. La bibliografía muestra que la respuesta inmune más eficaz se obtiene mediante la combinación de una vacuna viva, como primo-vacunación, con la inyección de otra inactivada unas semanas más tarde. Mientras que la respuesta inmune mediada por células disminuye la colonización de Salmonella a nivel intestinal, unos niveles altos de anticuerpos reducen fuertemente la colonización de los órganos y la transmisión de huevo de la misma.
- Tener un manejo adecuado del huevo en la granja, con recogidas frecuentes y protocolos de desinfección eficaces: el método más extendido es la fumigación con un producto a base de formaldehído en las condiciones adecuadas, a una temperatura de más de 24 ºC y con el 85 % de humedad relativa, durante 20 minutos.
En la sala de incubación:
- Minimizar los nacimientos múltiples dentro de una nacedora para evitar contaminaciones cruzadas.
- Implementación estricta de entrada del personal y los procedimientos de cambio de ropa: zapatos y gorros dedicados en exclusiva al edificio.
- Incubación de los huevos con un estatus conocido “libre de Salmonella”.
- Uso de la exclusión competitiva usando flora completa o específica con el fin de inhibir la colonización por Salmonella en los pollitos recién nacidos inmaduros.
- Agua: desinfección en el punto de entrada de la planta de incubación. La Salmonella es sensible a la cloración, pero una desinfección con cloro sólo es eficaz en condiciones específicas: un pH por debajo de 7 y un bajo nivel de hierro y materia orgánica. El dióxido de cloro es más apropiado cuando las condiciones químicas del suministro de agua no son adecuadas. La acidificación del agua también puede ayudar ya que la Salmonella raramente se desarrolla en ambientes más básicos.
- Control de plagas: las trampas y raticidas deben ser colocados en varios puntos de paso críticos y las moscas se desarrollan más fácilmente con el calor y la gallinaza líquida, donde las larvas suelen habitar. Los escarabajos y los gusanos de la harina deberían eliminarse en cada etapa de limpieza y desinfección mediante pulverización de insecticidas en la parte inferior de las paredes para -por los adultos-, así como en la cama -por las larvas-.
- Seres humanos: las medidas específicas que se mencionan en las explotaciones se pueden aplicar también en la planta de incubación. Asegurarse de que el personal garantice que no posee aves de corral u otros animales de granja que representen un riesgo y comprobar regularmente su estatus sanitario.
Tabla 1. Ejemplo de un programa de monitoreo de Salmonellas (S. gallinarum pullorum, S. typhimurium, S. enteritidis, etc.)
|
¿Cuándo? |
Muestra |
Nº de muestras |
Test |
|
Una o dos veces al año |
Agua |
5 litros |
Bacteriología PTS |
|
Cada nacimiento |
Hisopo |
Cada hacedora |
Bacteriología PTS |
|
Cada nacimiento |
Pollitos |
10 por manada |
Almacén refrigerado, 40-60 días |
|
Reproductores de 34 y 50 semanas |
Huevos picados, sin nacimiento |
20 por manada |
Bacteriología SGP |
|
Cada 14 días |
Hisopos de la nacedora |
Monitoreo post-desinfección |
Bacteriología PTS |
|
Dependiendo de la epidemiología local |
Sangre del pollito |
60 |
Serología SGP |
|
Cada mes |
Hisopos en la incubadora |
Monitoreo post-desinfección |
Bacteriología PTS |
Paso 3: Seguimiento de la eficacia de las medidas implementadas
Cualquier estrategia de reducción de riesgo es inútil si no hay un control y un registro de su eficacia. La estrategia de seguimiento es la clave del éxito del status “libre de Salmonella”: las muestras adecuadas, tomadas en el momento adecuado y analizadas con el método adecuado.
Tres métodos son utilizados comúnmente para la detección de Salmonellas: cultivos bacterianos, serología y PCR.
Tipos y métodos de muestreo:
La detección de Salmonella se puede realizar sobre material de las aves –hígado o ciegos– o con muestras ambientales –hisopos y cubrepiés-. Para la detección de Salmonellas SGP es preferible utilizar únicamente material de las aves ya que las muestras ambientales pueden dar lugar a falsos negativos. Los ciegos y las tonsilas cecales son la muestra más fiable para ese fin.
A nivel de granja, junto con los cubrepiés caminando sobre la cama, el empleo de hisopos en los nidales, las cintas de huevos, los comederos, las paredes y cualquier otra zona polvorienta en la que se hallen las aves también es muy sensible para la detección de Salmonellas PTS.
A nivel de la planta de incubación, los hisopos de la nacedoras o en las cintas de los pollitos son el material recomendado. La Salmonella también puede aislarse de otras fuentes potenciales, tales como el pienso, el agua, las materias primas y las plagas.
Los métodos de cultivo bacteriano se han descrito ampliamente en numerosos documentos oficiales –OIE, US NPIP, ISO 6579 v.2007, por ejemplo- y los lectores deben referirse a ellos para más información.
La principal respuesta de los anticuerpos asociados con las infecciones de salmonela en las aboga por el de la serología. Las técnicas de aglutinación rápida están muy extendidas, junto con técnicas ELISA (*). Los anticuerpos en la yema del huevo también se detectan fácilmente. Sin embargo, hay limitaciones en la utilización sólo de la serología. Un resultado positivo no es necesariamente predictivo de una infección en curso. Además. hay un retraso entre el momento de la infección y la aparición de anticuerpos detectables. Las infecciones subclínicas o de bajo nivel a veces pueden aparecer indetectables por serología, mientras que los cultivos bacterianos son positivos. Por último, el uso de la serología no es relevante en aves vacunadas ya que es imposible diferenciar las vacunadas de las infectadas.
Frecuencia de muestreo:
Un programa de muestreo debe ser elaborado teniendo en cuenta las normativas legales si hay alguna limitación epidemiológica local. Un ejemplo de un protocolo de muestreo exhaustivo a nivel de explotación se muestra en la tabla 1. En el presente programa, el muestrear cada nacedora de cada planta de incubación mediante hisopos es un método fácil y eficaz para controlar y realizar un seguimiento de las infecciones de salmonela que pueden producirse en las mismas. El agua se verifica dos veces al año y la serología de las salmonelas SGP se realiza sobre 60 aves, lo que permite una detección del 5 % de prevalencia con un intervalo de confianza del 95%.
(*) N. de la R.: ELISA: “Enzyme linked immunoavsorvent assay”, Enzima inmuno-ensayo.
Paso 4: Catering para el peor de los casos
Un plan de contingencia tiene que estar preparado en caso de que en la sala de incubación tenga lugar una detección de la salmonela. La bacteria es usualmente muy sensible a la mayoría de agentes químicos pero se debe tener cuidado al utilizar la dosis recomendada ya que la exposición a concentraciones subóptimas puede provocar resistencias. Una estrategia corriente combina detergentes jabonosos, la pulverización de un desinfectante acreditado en todas las superficies y un acabado mediante fumigación de otro desinfectante en el aire: el amoníaco/glutaraldehído y formaldehído son eficientes y ampliamente utilizados y el ortofenilfgenol es una alternativa.
El tratamiento con antibióticos es un debate caliente y hay autores que desaconsejan su uso ya que implica una selección potencial de resistencia que puede ser transmitida fácilmente. Por otra parte. la eficacia de los tratamientos con antibióticos es inconsistente: desde una protección real a la potenciación de la infección por salmonella debido a la erradicación de la microflora natural en los primeros días de vida.
El plan debe incluir una investigación completa de las causas potenciales de infección con el fin de evitar una detección recurrente.
Conclusión
El estatus de libre de Salmonella en las plantas de incubación requiere la participación de todos. Elaborar una estrategia para lograrlo y, lo más importante, mantenerlo en sí requiere fijar un conjunto de reglas a seguir cualquiera que sea la especie.
El enfoque de 360º que se muestra en la figura adjunta representa el equilibrio entre los cinco pilares que equilibran la estrategia. Cualquiera que sea el ángulo de ataque la planta de incubación permanecerá incólume.
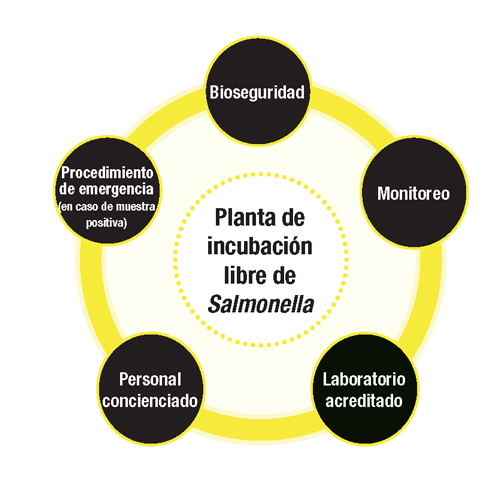
Fig. 1. Enfoque de 360º para librarse de Salmonella en la planta de incubación.
Con el apoyo de:

Categorías

Vencomatic
Leer
Laboratorios Calier
Leer
Ingenieria Avicola
Leer
Norel
Leer
Exafan
Leer
Big Dutchman
Leer
 Revistas
Revistas Archivo
Archivo La revista de la industria
La revista de la industria











































 PDF
PDF