Este artículo es parte de la edición de junio, 2014
EVOLUCIÓN EN LA VACUNACIÓN FRENTE A LA ENFERMEDAD INFECCIOSA DE LA BOLSA
Michel Bublot
Merial SAS-Lyon-France
La enfermedad infecciosa de la bolsa y el papel de la bolsa de Fabricio
La enfermedad infecciosa de la bolsa –IBD- también se denomina enfermedad de Gumboro, debido a los primeros brotes acontecidos en el área de Gumboro en Delaware, Estados Unidos, a principios de 1960. Se trata de una enfermedad de distribución mundial y causa grandes pérdidas económicas a la industria avícola. El agente etiológico es el virus IBD que se replica mayoritariamente en la bolsa de Fabricio.

La bolsa de Fabricio es uno de los dos órganos linfoides primarios de las aves. Juega un papel esencial en el desarrollo de la respuesta inmune humoral. Durante la embriogénesis, la bolsa es colonizada por los progenitores de los linfocitos B, que invadirán y madurarán en ella. Cada precursor de célula B tiene un receptor de inmunoglobulina –Ig- en su superficie. El gen que codifica para el receptor de Ig se someterá a la conversión génica, un proceso genético que dará lugar a células B maduras con una amplia diversidad de receptores de Ig capaces de reconocer una gran variedad de antígenos. Tras la incubación, las células B emigran desde la bolsa a la periferia, incluyendo el bazo y otros tejidos linfoides secundarios, donde desempeñarán un papel crucial en la respuesta inmune humoral. El repertorio de anticuerpos se expande hasta que se consigue la madurez de éstos entre las 5 y 7 semanas de edad, cuando la bolsa está totalmente madura –Davison, 2014-. La gran diversidad y cantidad de linfocitos B creados en la bolsa es esencial para la total inmuno-competencia de las aves.
El virus de la enfermedad infecciosa de la bolsa y los anticuerpos maternos
Los pollitos nacidos a partir de aves reproductoras vacunadas tienen niveles elevados de anticuerpos de origen materno –MDA- frente al virus IBD, que disminuyen a medida que las aves crecen. El virus IBD es extremadamente resistente y es difícil eliminarlo de las granjas. Las aves se infectan por vía digestiva y a través del torrente circulatorio el virus alcanza la bolsa de Fabricio. En las primeras semanas, los MDA neutralizan al virus IBD antes de que éste pueda alcanzar la bolsa, pero cuando el nivel de MDA disminuye por debajo del umbral -considerado como el nivel de protección-, los virus IBD de campo escapan a esta neutralización por MDA y empiezan a replicarse, principalmente en las células B progenitoras de la bolsa de Fabricio, lo que da lugar a la destrucción de las células infectadas.

El virus IBD puede también replicarse en otras células y tejidos. La replicación vírica y la respuesta inflamatoria severa, caracterizada por una “tormenta de citoquinas”, causarán signos clínicos que podrían inducir una mortalidad incluso superior al 20 % en casos de virus IBD muy virulentos. Otro tipo de cepas víricas como las variantes no dan lugar a signos clínicos evidentes durante la fase de replicación vírica. Sin embargo, todos los virus IBD producirán una depleción de células B y atrofia de la bolsa, que no será capaz de liberar linfocitos B maduros y, por tanto, la cantidad y diversidad de células B disponibles en la periferia disminuirá.
Inmunosupresión inducida por virus IBD
La inmunosupresión inducida por el virus IBD es una consecuencia directa de la infección de células inmunes específicas, además de una consecuencia indirecta en el hospedador. Tras la infección, ambos tipos de respuesta inmune -humoral y celular- estarán afectadas -Ingrao y col., 2013-. El grado de inmunosupresión depende de diferentes factores tales como: la cepa del virus IBD, la estirpe -las gallinas ponedoras son más sensibles que los broilers- y la edad a la que se produce la infección.

Los efectos inmunosupresores producidos tras una infección por el virus IBD a las 3-4 semanas de edad incluyen un porcentaje inferior de células B -Hirai y col., 1981-, menor respuesta serológica a los antígenos -Dohms y Jaeger, 1988-, reducción de células plasmáticas en la glándula de Harder -Dohms y colk., 1988-, menor respuesta de las células linfoides a la estimulación mitogénica -Sharma y Lee, 1983-, y una mayor sensibilidad al desafío por E. coli -Wyeth, 1975-. Estos efectos pueden ser transitorios y normalmente alcanzan el pico máximo entre las 1-3 semanas después de la infección por IBDV, siendo esta edad la correspondiente con el final del periodo de crecimiento de los broiler tipo estándar.
Por lo tanto, se considera a la inmunosupresión como un factor importante a tener en cuenta en las notables pérdidas económicas ocasionadas por la mortalidad tardía y los decomisos en matadero
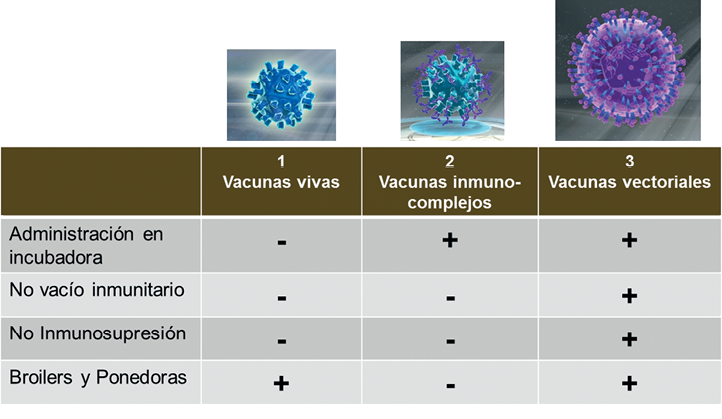
Primera generación de vacunas frente a IBD: vivas atenuadas administradas en agua de bebida
Las vacunas vivas de primera generación son administradas en el agua de bebida en las granjas. Hay muchos motivos por los cuales se producen fallos de vacunación como no respetar la cadena de frío, el momento de vacunación y la calidad del agua. Las vacunas frente a IBD tienen que ser administradas cuando el nivel de anticuerpos maternos permita su replicación y por debajo del umbral de protección. Este nivel es más elevado en el caso de las vacunas intermedias plus en comparación con las de tipo intermedio. Si la vacunación se hace en el momento correcto, el virus se dirige a la bolsa de Fabricio, donde se replicará antes de inducir la respuesta inmunitaria. Hay un periodo de vulnerabilidad ante los virus virulentos IBD en el cual el título de anticuerpos IBD está por debajo del nivel de protección. Se denomina “vacío inmunitario” el cual es menor en el caso de las vacunas intermedias plus.
El daño ocasionado en la bolsa por la replicación de los virus vacunales reduce la cantidad y diversidad de células B bursales en los órganos linfoides secundarios, dando lugar a la inmunosupresión. Será menos severa en el caso de vacunas intermedias que con las de tipo intermedia-plus. Las lesiones bursales inducidas por las vacunas dificultan la valoración de la protección de la vacuna -Rautenschlein y col., 2005-.
Segunda generación de vacunas frente a IBD: vacunas de inmunocomplejos
Las vacunas de inmunocomplejos –ICx- son la segunda generación de vacunas frente a IBD. Desarrolladas en los años 80 -Sharma, 1985-, comprenden una cepa vacunal intermedia plus -Winterfield 2512- unida a anticuerpos. La principal ventaja de este tipo de vacunas es su administración en la incubadora, tanto in ovo como subcutáneamente. Se piensa que el ICx persiste en los órganos linfoides de las aves vacunadas ligado a la superficie de células dendríticas foliculares -Jeurissen y col., 1998-.
Cuando los MDA alcanzan el nivel por el cual la vacuna intermedia plus no es neutralizada, el virus empieza a replicarse en la bolsa e induce una respuesta inmune. Aún quedaría un “vacío inmunitario” debido a que los virus muy virulentos –vvIBD- y variantes del virus IBD podrían sobrepasar los niveles de MDA, que son superiores al nivel al cual la vacuna intermedia plus empieza a replicarse. Se necesita la replicación vacunal para inducir una respuesta inmune protectora.
Los daños producidos en la bolsa por la cepa vacunal Winterfield 2512 son bastante severos e inducirán inmunosupresión -Corley y Giambrone, 2002-. Por motivos de seguridad, las vacunas de inmunocomplejos no pueden utilizarse en pollitas.
Tercera generación de vacunas frente a IBD: vacunas vectoriales HVT
Fueron necesarias nuevas biotecnologías para desarrollar la tercera generación de vacunas frente a IBD, las vacunas vectoriales basadas en el virus HVT, ampliamente utilizado para prevenir la enfermedad de Marek -MD; Darteil y col., 1995-. El gen que codifica para la proteína VP2 del virus IBD fue clonado y transferido al genoma de HVT junto con señales reguladoras de transcripción -el promotor upstream y la señal de post-adenilación Downstream-.
Al igual que las vacunas de inmunocomplejos, la vacuna vectorial se administra en la incubadora tanto in ovo como subcutáneamente. Puede administrarse junto con vacunas MD SB1 y CVI988 –Rispens- y junto con la vectorial de viruela aviar-influenza H5 o con vacunas frente a Newcastle inactivadas. Sin embargo, no debería ser administrada simultáneamente junto con HVT u otras vacunas vectoriales basadas en HVT.
Tras la vacunación, el vector HVT infectará y se replicará en las células hospedadoras sin ser afectado por los MDA. Durante la replicación de HVT, se sintetiza proteína VP2 del virus IBD en el citoplasma de las células infectadas. Las lisis de las células infectadas libera la proteína VP2 que activará células B cuyos receptores de inmunoglobulina reconocen la VP2.

Las células B activadas se multiplicarán y se transformarán en plasmocitos o células B memoria. Los plasmocitos secretan anticuerpos anti-VP2 que irán reemplazando a los MDA progresivamente, previniendo el denominado “vacío inmunitario”. El nivel global de anticuerpos nunca estará por debajo del umbral de protección, previniendo por tanto el ataque de la bolsa de Fabricio por el virus IBD de campo con independencia del tipo de cepa: clásica, variante o muy virulenta -Le Gros y col., 2009; Perozo y col., 2009-. El vector HVT también inducirá una inmunidad de tipo celular anti-IBDV a partir de VP2 localizadas en los epítopos de las células T -Pradhan y col., 2012-.
La bolsa permanece intacta, aumentando la cantidad y diversidad de células B a través del cuerpo y así, el sistema inmunitario del ave podrá ofrecer una respuesta óptima a los antígenos externos. A diferencia de la vacunas ICx, la vacuna vectorial HVT-IBD es segura y eficaz para todos los tipos de aves, incluyendo pollos y ponedoras. Estudios de campo desarrollados con este tipo de vacuna han mostrado mejoras en el rendimiento, mejor respuesta a otras vacunas, menor utilización de antibióticos y menor porcentaje de decomisos en matadero.
Conclusión
El balance seguridad/eficacia observado en las vacunas vivas frente a la enfermedad de Gumboro, incluyendo la vacuna ICx, se resolvió gracias a las nuevas biotecnologías. La tecnología vectorial HVT no solo permite la administración en la sala de incubación frente a las dos enfermedades inmunosupresoras más importantes -Marek y Gumboro-, sino que también es la solución para evitar el “vacío inmunitario” y protege de forma exhaustiva la integridad de la bolsa de Fabricio frente a todos los tipos de virus IBD, tanto en broilers como en ponedoras. Esto significa que las aves vacunadas con la 3ª generación de vacunas frente a IBD mantienen todo su repertorio de células B intacto para responder de un modo positivo a otras vacunaciones y agentes patógenos presentes en las granjas, optimizando los rendimientos de la producción. El desafío para el futuro será desarrollar nuevas vacunas HVT-IBD totalmente compatibles con otras vacunas vectoriales HVT para aplicar un programa vacunal completo en la sala de incubación.
Bibliografía: Se enviará a quienes la soliciten.
Con el apoyo de:

Categorías

Pollos Planes extenderá sus restaurantes en franquicias por toda España
Leer
CreAMINO
Leer
Silos Cordoba
Leer
Cosma
Leer
Agro word
Leer
New Farms
Leer
 Revistas
Revistas Archivo
Archivo La revista de la industria
La revista de la industria











































 PDF
PDF