Este artículo es parte de la edición de septiembre, 2014
b-GALACTOMANANOS VEGETALES HIDROLIZADOS para prevenir la invasión intestinal de Salmonella en avicultura
SERGI CARNÉ*, ANNA ZARAGOZA
Departamento Técnico, Industrial Técnica Pecuaria, S.A. (ITPSA)
*[email protected]
Introducción
La salmonelosis es una de las enfermedades transmitidas a través de los alimentos más comunes en todo el mundo. La mayoría de las infecciones humanas son transmitidas por los alimentos y se deben mayoritariamente a Salmonella enteritidis y thyphimurium. Además, más de 65% de casos de salmonelosis en humanos son debidos al consumo de huevos contaminados.
Desde el 2003, existe una legislación europea -Reglamento CE 2160/2003- más estricta y específicamente enfocada al control de la Salmonella y otras enfermedades transmitidas por los alimentos. Este marco legislativo establece objetivos anuales de reducción obligatorios, específicos para cada país y en función de la prevalencia de años anteriores. Estos objetivos de reducción se vienen aplicando de forma gradual desde 2010 en el sector avícola -reproductoras, gallinas ponedoras, pollos y pavos-.
El esfuerzo del sector en la implementación de medidas de control ha dado como resultado que en los últimos años se haya conseguido una reducción muy importante de la prevalencia en nuestras explotaciones. Aun así, Salmonella y Campylobacter siguen siendo las 2 principales infecciones alimentarias en humanos, por lo que la industria no ha dejado de trabajar en la mejora de la implementación de medidas que permitan seguir reduciendo estos casos.
Plan integral de control
En la lucha contra las enfermedades infecciosas, la combinación de distintas medidas y herramientas en el marco de un plan integrado de control es la estrategia más eficaz. Un programa integral de control debe contemplar invariablemente la implementación de unas buenas prácticas de bioseguridad y manejo.
Las medidas de bioseguridad abarcan una gran variedad de acciones, entre las que podemos enumerar el propio emplazamiento de la explotación, la distribución de las instalaciones, el vallado perimetral con accesos controlados y sistemas de desinfección para vehículos, los pediluvios y la eliminación de residuos.
En el caso de las medidas específicas de manejo, se tratarían primordialmente de planes de limpieza y desinfección, de control de insectos y roedores, aplicación de un sistema de cría “todo dentro-todo fuera” para evitar la recirculación de la infección dentro de la explotación, y la higiene del agua y del pienso.
En cualquier caso, cualquier medida que pueda plantearse no debe nunca considerarse de forma aislada ni definitiva, sino como una herramienta más para optimizar la eficacia del plan integral de control del que debe formar parte.
Agentes protectores contra Salmonella a través del pienso
La infección por Salmonella, Campylobacter y otras enterobacterias se produce de forma mayoritaria por transmisión horizontal por vía oral. Por tanto, la inclusión de agentes protectores en el pienso que protejan frente a enterobacterias procedentes del propio pienso y cualquier otro origen que implique la entrada de estas bacterias al tracto gastrointestinal -comederos, bebederos, heces, cama, insectos, etc-, es una herramienta eficaz a explotar.
La estrategia más documentada a este respecto son los ácidos orgánicos de cadena corta, con sus distintas combinaciones en forma libre o en forma de sal, siendo especialmente efectivas las sales amónicas, principalmente de ácido fórmico. Aun así, su eficacia va ligada a niveles elevados de inclusión en pienso, y se ve reducida a lo largo del tracto intestinal por la natural absorción intestinal. Otras, estrategias como los probióticos o los aceites esenciales también han sido propuestos.
Por otro lado, en los últimos años se ha estudiado el enorme potencial de los biopolímeros de carbohidratos -Gast y col., 2007-. Estos biopolímeros aparecen de forma natural en la fracción soluble de la fibra en la dieta del animal y tiene propiedades prebióticas -Zhang, 2004-. Los más efectivos contra la infección de Salmonella y otras enterobacterias como Campylobacter son los que tienen un alto contenido en manosa. La manosa es un monosacárido que tiene la particularidad de adherirse con gran especificad a las adhesinas Fim H de las fimbrias tipo I en la superficie de muchas enterobacterias -Oyofo y col., 1989-. Estos patógenos utilizan las fimbrias para reconocer residuos de manosa en las glicoproteínas de la superficie celular de la mucosa intestinal del ave. De esta forma, los patógenos se adhieren mediante estas fimbrias a la pared intestinal como paso previo e imprescindible para penetrar en los enterocitos e invadir el tejido linfoide.
Por tanto, la utilización de compuestos ricos en manosa permite inutilizar la capacidad de invasión de las bacterias mediante el bloqueo de sus fimbrias. Sin embargo, no solo es el contenido en manosa sino la estructura de la molécula la que determina la eficacia de estos carbohidratos. Así, monómeros simples de manosa tienen una baja capacidad de bloqueo de las fimbrias bacterianas -Vilà y col., 2012), y dan como resultado unos niveles de daño tisular en intestino parecido al de animales no tratados -Badia y col., 2013-. Por el contrario, los oligomananos -carbohidratos de pequeño-mediano tamaño que contienen manosa-, se han mostrado muy eficaces al respecto y además tienen propiedades prebióticas, favoreciendo la flora intestinal propia y la exclusión competitiva de patógenos.
Se han utilizado paredes de levadura con este propósito, aunque el nivel de oligomananos en los productos comerciales difícilmente alcanza el 30%. Una alternativa más reciente es el uso de biopolímeros vegetales procedentes de las semillas de diversas leguminosas tales como algarrobo o guar. El endospermo de estas semillas se extrae para formar una goma que es una de las fuentes conocidas más ricas en mananos, en forma de β-galactomananos. Constituyen macromoléculas formadas por cadenas simples de hasta miles de unidades de manosa, que a lo largo de la cadena presentan ramificaciones de galactosa. La relación manosa:galactosa suele ser de 2,5-4:1. Esta fuente vegetal permite obtener productos con unos niveles de mananos superiores al 90%, no alcanzables por otras fuentes. Sin embargo, una de las características principales de los β-galactomananos es su propiedad espesante y gelificante en soluciones acuosas. Esto es un inconveniente para su uso en el pienso, puesto que afecta negativamente a la absorción de los nutrientes -Vilà y col., 2012.
Estos inconvenientes quedan solventados con el producto SALMOSAN®, una fuente de β-galactomananos vegetales cuya tecnología patentada permite el fraccionamiento mediante depolimerización de las largas cadenas de manosas, y así neutraliza totalmente la propiedad espesante de esta sustancia. Esto permite utilizar dosificaciones adecuadas sin afectar a la viscosidad intestinal ni a los niveles productivos del animal. Asimismo, los oligomananos resultantes tienen propiedades prebióticas.

Fig. 1. Adhesión de Salmonella typhimurium a células intestinales en presencia de SALMOSAN® a distintas concentraciones. (µg/ml). (adaptado de Badia y col., 2012).
Bloqueo de las fimbrias bacterianas para impedir la adhesión intestinal
El modo de acción de SALMOSAN® ha sido estudiado por Badia y col. -2012-, que realizaron una serie de estudios sobre cultivos de células intestinales. Para ello añadieron 4×106 UFC de Salmonella typhimurium con o sin SALMOSAN®. En la figura 1 se muestran los resultados de adherencia de la Salmonella a las células intestinales en función de distintas concentraciones del componente activo y en comparación con cultivos sin Salmonella (control -) y sin SALMOSAN® (control +). La presencia de los β-galactomananos hidrolizados a 0,5 µg/ml inhibieron de forma significativa (P<0,05) la invasión de las células intestinales por la Salmonela en cerca del 60% respecto el control+. Con niveles de β-galactomananos de 10 µg/ml la reducción fue de más del 70% (P<0,01).
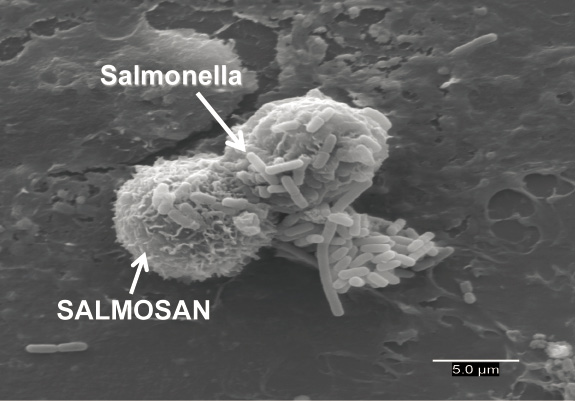
Fig. 2. Imágenes de microscopía electrónica de SALMOSAN® aglutinando Salmonella en tejido intestinal de pollo.
Estos mismos autores también han evaluado el efecto de SALMOSAN® en la capacidad de invasión intestinal de E. coli -Badia y col., 2012b- inoculando 107 UFC de E. coli K88 sobre células intestinales protegidas con distintas concentraciones de β-galactomananos hasta 20 µg/ml. Se observó una reducción de invasión celular de hasta el 80%. La presencia de adhesinas sensibles a la β-galactosa en E. coli parece que contribuye a la eficacia de los β-galactomananos en su bloqueo -Badia y col. 2013-. Las bacterias inhabilitadas por SALMOSAN® son eliminadas con las heces, sin capacidad infectiva.
Hay que tener en cuenta que para determinar si un producto es realmente eficaz, la cantidad de patógeno a inocular en este tipo de pruebas es necesariamente mucho mayor que el encontrado de forma natural en el intestino de un animal infectado. Por tanto, si bien los resultados indican una clara reducción en los niveles de adherencia de Salmonella en las células intestinales, en condiciones de granja la fracción de bacteria bloqueada es todavía más elevada, contribuyendo así al objetivo de una protección total del tracto intestinal frente a enteropatógenos.
La Salmonella no adherida queda bloqueada y aglutinada por los β-galactomananos hidrolizados, tal como se observa en las imágenes de microscopía electrónica realizadas en la Facultad de Farmacia de la UB -figura 2-. En estas imágenes se distingue la estructura esférica y rugosa de estos β-galactomananos, que facilita la adhesión de las bacterias a las moléculas de manosa.
Efecto antiinflamatorio e inmunomodulador
Adicionalmente al hecho de suponer zoonosis alimentarias, la infección por Salmonella y otras enterobacterias también compromete la integridad intestinal del animal, con procesos inflamatorios y alteración de la llamada “función epitelial de barrera”, es decir, la función del tracto intestinal como principal barrera natural del animal contra patógenos externos -figura 3-. Esto puede desembocar en menor eficiencia alimentaria así como en mayor susceptibilidad a infecciones.
Se ha estudiado la expresión de RNA mitocondrial -RNAm- de diversas citocinas y quimiocinas proinflamatorias en el cultivo de células intestinales infectadas con Salmonella. Las citocinas y quimiocinas ejercen la función de mensajeros químicos entre células y participan en la coordinación de la respuesta inflamatoria e inmunitaria de los tejidos -Badia y col., 2012-. Por tanto, son buenos indicadores del proceso inflamatorio que sufren las células intestinales cuando son invadidas por patógenos entéricos como la Salmonella.
Los resultados obtenidos se muestran en la figura 3. El SALMOSAN® mostró un marcado efecto antiinflamatorio, con la reducción de RNAm para GM-CSF -factor estimulador de colonias de macrófagos y granulocitos- y las interleucinas IL-1 y IL-6 de hasta 2 veces respecto el control, incluso sin inoculación de Salmonella. Por otro lado, en presencia de Salmonella se redujo la expresión de RNAm del FNTα -factor de necrosis tumoral- y GM-CSF hasta en un 70% respecto al control. Los niveles para IL-1 también se redujeron hasta en 6 veces respecto a los enterocitos sin SALMOSAN®.
Por tanto, se ha confirmado el efecto antiinflamatorio e inmunomodulador de los β-galactomananos en la mucosa intestinal cuando su integridad se ve comprometida por la infección por Salmonella.
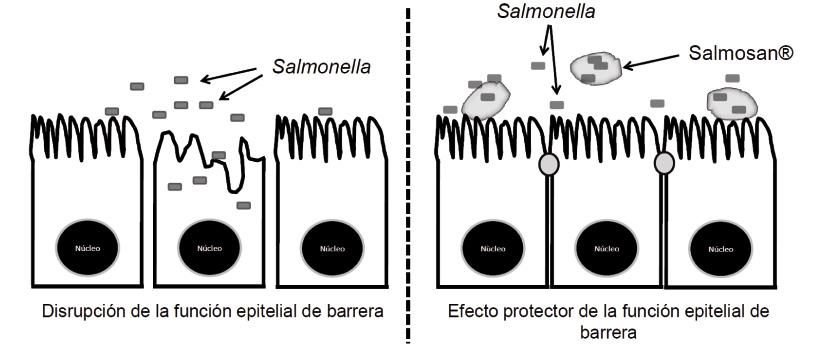 Fig. 3. Efecto de Salmonella en la disrupción de la función epitelial de barrera de la mucosa intestinal(Fuente: Facultad Farmacia UB).
Fig. 3. Efecto de Salmonella en la disrupción de la función epitelial de barrera de la mucosa intestinal(Fuente: Facultad Farmacia UB).
También se ha evaluado el efecto de los β-galactomananos sobre la morfología e integridad de la mucosa intestinal. Así, entre otros efectos Brufau y col. -2014- han observado que en pollos suplementados con estos carbohidratos no digeribles se produce un marcado aumento de células caliciformes o de Goblet, que tienen un papel relevante en la producción de la fina capa de moco que recubre el epitelio intestinal y que contribuye a su protección frente a la adhesión de agentes patógenos. Este aumento fisiológico de producción de moco también ha sido constatado por los autores.
Eficacia testada en pruebas in vivo
La eficacia de SALMOSAN® en el bloqueo de patógenos a nivel intestinal ha sido confirmada tanto en ponedoras como en pollos de engorde. Así, se utilizaron 225 ponedoras HyLine que fueron inoculadas con S. enteritidis -109 UFC- a los 27 días tras empezar a recibir SALMOSAN® en la dieta a razón de 1 kg/Tm de pienso. Se realizaron análisis microbiológicos de ciego y ovario y se observó que desde el inicio la susceptibilidad a la infección era menor en el grupo tratado (6,3 vs. 25%). Asimismo, a las 4 semanas post-inoculación los animales infectados del grupo en tratamiento dejaban de excretar el patógeno y sus tejidos no aparecían infectados -tabla 1-.
En pollos de engorde también se ha confirmado esta protección frente a la infección. Así, Zaaboune y col. -2013- utilizaron 150 pollos por tratamiento y fueron inoculados oralmente con Salmonella enteritidis -108 UFC- a los 7 días de edad. A los 21 días de vida la presencia de bacteria en los ciegos era del 25% en el grupo control, mientras que no se observó infección en el grupo que también recibió SALMOSAN® dosificado a 1 kg/Tm de pienso.
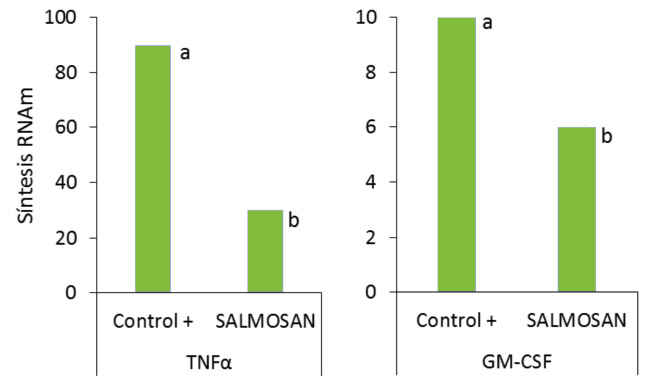
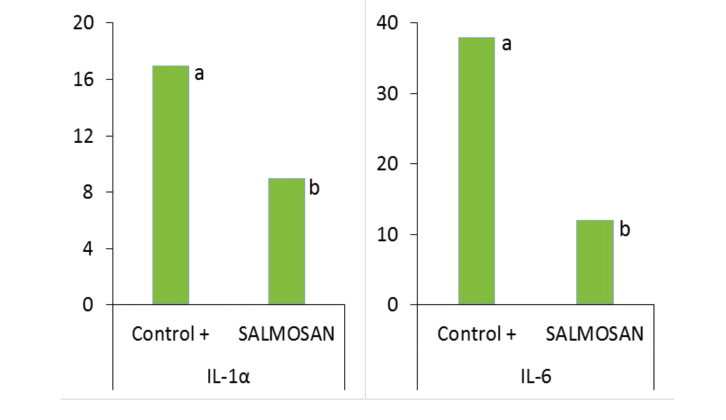
Fig. 4. Efecto de SALMOSAN® en la síntesis de RNAm para la producción de sustancias proinflamatorios en células intestinales ante la Salmonella.
Tabla 1. Ponedoras positivas a Salmonella enteritidis en ciego tras 5 meses post-infección (109 UFC).
|
Tratamientos |
30 días |
90 días |
120 días |
150 días |
|
Control + |
25a |
25a |
12,5a |
12,5a |
|
SALMOSAN® (0.1 %) |
6,3b |
6,3b |
0b |
0b |
Conclusión
Los β-galactomananos vegetales son la fuente más rica en mananos disponible. Estos mananos son muy eficaces en el bloqueo de enterobacterias como Salmonella, impidiendo así que invadan la mucosa intestinal. Además, el tratamiento para despolimerizar estos β-galactomananos permite su utilización a dosis adecuadas sin que aumente la viscosidad intestinal y no afecte a la absorción de nutrientes. Asimismo estos componentes hidrolizados tienen propiedades prebióticas e inmunoestimulantes, y protegen la integridad de la pared intestinal del ave.
Bibliografía
Badia y col. 2012a. Galactomannan and saccharomyces cerevisiae var. boulardii modulate the immune response against salmonella enterica serovar typhimurium in porcine intestinal epithelial and dendritic cells. Clin. Vaccine Immunol, 19:368-376.
Badia y col. 2012b. Effect of Saccharomyces cerevisiae var. Boulardii and b-galactomannan oligosaccharide on porcine intestinal epithelial and dendritic cells challenged in vitro with Escherichia coli F4 (K88). Veterinary Research. 43:4.
Badia y col. 2013. Oligosaccharide structure determines prebiotic role of b-galactomannan against Salmonella entérica ser. Typhimurium in vitro. Gut Microbes. 4:72-75.
Brufau y col. 2014. Morfologia de l’intestí de pollastres inoculats amb Salmonella enteritidis i alimentats amb una dieta suplementada amb un producte ric en β-galactomannans (Salmosan®). Quaderns Agraris, 36:7-22.
Gast y col. 2007. In Vitro Penetration of Egg Yolks by Salmonella Enteritidis and Salmonella Heidelberg Strains during Thirty-Six-Hour Ambient Temperature Storage. Poult. Science, 86:1431-1435.
Oyofo y col. 1989. Prevention of Salmonella typhimurium colonization of broilers with D-mannose. Poultry Science, 68:1357-1360.
Vilà y col. 2012. Effects of carob bean gum on performance, nutrient digestibility and Salmonella enterica var. enteritidis colonisation in chickens. Food Research International, 45:1133–1138.
Zhang C. 2004. Evaluation of guar meal as a source of prebiotic galactomannans for laying hens. Doctoral Thesis. Texas A&M University.
Zaaboune M. I. 2013. Eficacia de la aplicación de productos ricos en β-galactomananos en dietas para pollos infectados o no con Salmonella. Tesis de Master. CIHEAM-IAMZ. Zaragoza.
Con el apoyo de:

Categorías

Agro Supply – Intercambiador de calor Clima 200+
Leer
Salmonella360.com
Leer
Chore-Time
Leer
Equipamiento y construcción. Naves llave en mano
Leer
Naves ganaderas, almacenes y cobertizos
Leer
Roxell – NestFarms – Fancom – Plasson. Efectividad asegurada
Leer
 Revistas
Revistas Archivo
Archivo La revista de la industria
La revista de la industria











































 PDF
PDF