Este artículo es parte de la edición de julio, 2014
ALTERACIÓN DE LA EFICACIA DEL TRATAMIENTO ANTIBIÓTICO EN AGUA DE BEBIDA EN PRESENCIA DE HIGIENIZANTES
José Eulogio Pérez Ruiz
Veterinario. S.P. Veterinaria, S.A.
Jornadas Prof. de Avicultura. Sevilla, 25/28-3-2014
Introducción
La estabilidad de los antibióticos en el agua de bebida es uno de los requisitos requeridos para demostrar su calidad y su eficacia y forma parte de la documentación de registro que los laboratorios presentan a las autoridades competentes -Agencia Española de Medicamentos y Productos Sanitarios, AEMPS y Agencia Europea del Medicamento, EMA- en los dossiers de registro.
Por otra parte, para mantener las condiciones de higiene de las granjas, tiene interés el uso de aguas potables con adecuadas condiciones físico-químicas y, sobre todo, microbiológicas, a fin de poder asegurar su estado sanitario, evitando infecciones o alteraciones digestivas en los animales. En muchas ocasiones, la procedencia de las aguas no es de la red pública potable, sino que se trata de aguas subterráneas cuyas condiciones sanitarias, al menos desde un punto de vista microbiológico, dejan que desear, y por lo tanto deben ser potabilizadas o higienizadas en las explotaciones in situ.
Por razones de facilidad, economía y efectividad, el uso de desinfectantes químicos es el más extendido en nuestras granjas avícolas y especialmente son tres los más utilizados: hipoclorito de sodio –NaClO-, peróxido de hidrógeno -H2O2- y dióxido de cloro -ClO2-.
La existencia de estas sustancias químicas de potabilización en el agua de bebida, junto a la necesidad de realizar tratamientos terapéuticos, en especial antibióticos, abre la incertidumbre sobre las reacciones químicas que puedan existir y la repercusión en la efectividad del antibiótico.
Este es el objeto de las pruebas que se han realizado para observar la repercusión que los desinfectantes más utilizados en avicultura tienen sobre tres antibióticos muy usados y que emplean el agua como vía de administración: tilosina, enrofloxacina y doxiciclina.
La tilosina tartrato es un antibiótico del grupo de los macrólidos que en avicultura está indicada preferentemente para las micoplasmosis, en procesos respiratorios como CRD -enfermedad crónica respiratoria-, aerosaculitis, sinovitis y enteritis necrótica -Cl.perfringens-.
Se considera una base débil muy estable a pH entre 6 y 8, aunque en presencia de aguas muy duras puede tener tendencia a precipitar.
La enrofloxacina es un antibiótico de amplio espectro, del grupo de las fluoroquinolonas, con carácter ácido débil. En avicultura es usado para el tratamiento de procesos, ya sean digestivos o respiratorios, en los que se presentan bacterias sensibles como E. coli, Pasteurella y Micoplasma.
La doxiciclina es un antibacteriano del grupo de las tetraciclinas y está indicado en avicultura para el tratamiento de colibacilosis y micoplasmosis asociadas a enfermedad crónica respiratoria. Es una molécula sensible a procesos de formación de complejos de coordinación, foto-oxidación, epimerización e hidrólisis.
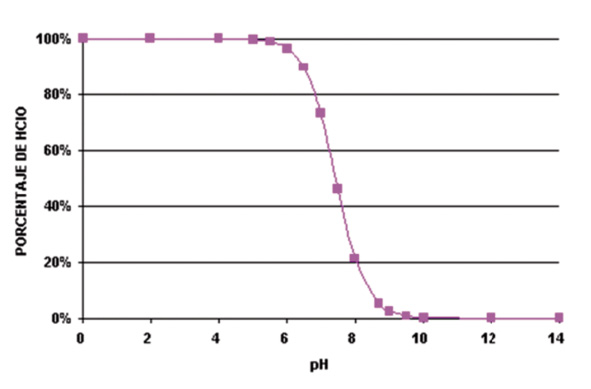
Fig.1. Concentración de HCLO en función del pH
El tratamiento en el agua de bebida
El uso de la vía del agua de bebida como forma de administración de medicamentos a las aves de producción con alto número de animales presenta multiples ventajas: facilidades de manejo, ahorro económico, rápidez en la instauración del tratamiento y flexibilidad para adaptarse a la intensidad en cada momento. Aparte de ello, la disminución de la ingesta de agua en las aves enfermas está menos afectada en comparación con la del alimento.
Finalmente, deberemos considerar la importancia de la interacción agua/medicamento –antibiótico- en base a parámetros como el pH, la dureza del agua, la contaminación microbiológica, la presencia de materia orgánica o de otras moléculas químicas y, sobre todo, la de potabilizadores del agua o higienizantes, objeto de nuestro artículo.
Potabilizadores químicos del agua
Revisaremos brevemente los 3 desinfectantes químicos más usados.
El hipoclorito sódico es probablemente el desinfectante químico más utilizado en la potabilización de las aguas, por razones de economía, fácil uso y efectividad; por lo tanto, con un buen balance costo/beneficio es recomendado como sistema eficaz de tratamiento y potabilización de aguas en todo el mundo.
Las dosis óptimas de potabilización con el fin de evitar la presencia de cloro residual con mayor poder oxidante de los antibióticos es entre 0,8-1 ppm (mg/l).
No obstante son conocidas algunas de sus limitaciones que se deben tener en cuenta: su espectro de eficacia sería más reducido que otros desinfectantes y la presencia de materia orgánica disminuye la misma y produce compuestos organoclorados tóxicos, como los trihalometanos. Con respecto de su actividad frente al biofilm, resulta menos efectivo que otros desinfectantes. Su estabilidad en el agua no es muy buena y es muy volátil, con lo cual desde el inicio de línea, donde se dosifica, hasta el final se observan diferencias que en ocasiones obligan a una dosificación mayor inicialmente para obtener dosis efectivas al final de la instalación.
Si tenemos en cuenta el equilibrio químico del hipoclorito sódico en el agua, veremos que su eficacia es máxima a pH menores de 6,5, en los que el ácido hipocloroso -con mayor capacidad desinfectante-, está presente mayoritariamente frente a la menor presencia del ion hipocloroso -con menor capacidad desinfectante-. En los pH neutros la relación de componentes va cambiando y disminuye la presencia del ácido hipocloroso frente al ion hipoclorito y, por lo tanto, el poder desinfectante.
El peróxido de hidrógeno es un compuesto desinfectante muy oxidante con amplio espectro contra bacterias, hongos, levaduras, virus, esporos y algas. Su actividad desinfectante no depende del pH y resulta algo más eficaz en presencia de materia orgánica. La dosis óptima de uso es de 15 mg/l.
Su actividad oxidante se ve incrementada por la producción de radicales libres hidroxilo.
El dióxido de cloro es de un desinfectante oxidante con un amplio espectro de actividad -bacterias, hongos, levaduras, virus, esporos y algas-, tampoco depende del pH y es activo en presencia de materia orgánica. Su inconveniente principal son los altos costes iniciales y de mantenimiento, pero sobre todo un manejo algo técnico por requerirse la unión de dos componentes químicos: el hidrogeno sulfato de sodio junto al persulfato de sodio, por una parte, unido a clorito de sodio, por otra, para la generación de dióxido de cloro soluble y estabilizado, con actividad de unas semanas. Los sistemas más sofisticados pueden generarlo en continuo y la dosis recomendada en la potabilización es de 0,2-0,5 ppm.
Pruebas de desinfectantes del agua-antibióticos
El objetivo de la presente exposición es presentar los resultados de algunos ensayos in vitro realizados en el nuestro laboratorio de control calidad en el que enfrentamos unos antibióticos muy usados en avicultura, a la dosis general de tratamiento en el agua medicada, tilosina, enrofloxacino y doxiciclina, a probablemente los 3 higienizantes más extendidos en la potabilización de las aguas de las granjas avícolas: hipoclorito de sodio, peróxido de hidrógeno y dióxido de cloro.
Planteamiento general del estudio in vitro
Se realizan dos ensayos con las siguientes características:
- En el primer ensayo se establece el enfrentamiento de estos antibióticos en la dosis de uso, pero ante la dosis alta de los desinfectantes, determinándose durante 18-24 h la concentración de aquellos, es decir, su estabilidad.
- En el segundo estudio se utilizan los mismos antibióticos a las mismas dosis, enfrentándose a los desinfectantes pero en las condiciones óptimas de uso de estos, es decir, a las dosis para la óptima potabilización del agua y se determina la estabilidad de los principios activos de aquellos en presencia de estos en 18-24 h.
Para ambos estudios se usan cuatro tipos de agua -2 blandas o semiblandas y 2 duras- y se cuantifican los antibióticos por cromatografía líquida de alta resolución -HPLC-DAD-UV- y se valora su estabilidad en unas 24 h.
Los tres antibióticos utilizados se dosifican en el agua a las dosis habituales en avicultura para ambas pruebas –tabla 1-, al igual que los desinfectantes a los que se enfrentaron –tabla 2-.
En cada una de las pruebas se utilizaron los dos tipos de aguas cuyas especificaciones físico–químicas se describen en la tabla 3.
Condiciones generales de ambos ensayos
El procedimiento general resumido fue el siguiente:
- Cada uno de los antibióticos se añade, a la dosis indicada, en los dos tipos de agua.
- Se agita 2 minutos hasta disolución.
- Se divide cada tipo de agua en cuatro partes para la dosificación de los tres desinfectantes y se deja una cuarta parte de cada una como agua control tratada, con la misma dosis del antibiótico pero sin desinfectantes.
- Se agita para la homogenización de los desinfectantes.
- Una vez preparadas las aguas, se procede a su análisis por técnicas HPLC-DAD-UV para cada uno de los antibióticos, durante 18-24 h.
Resultados con tilosina
Los resultados obtenidos en la prueba de cuantificación del antibiótico durante las 24 horas posteriores al enfrentamiento con los desinfectantes, tanto para las dosis altas y dosis óptimas, se muestran en las figuras que se muestran a continuación.
La tilosina resulta estable en las aguas control -blanda y dura- durante las 24 h contempladas en ambos ensayos con valores > 98 a lo largo de la prueba -por lo tanto una estabilidad por encima del 95 %-
El hipoclorito sódico –NaClO- , añadido a 5 mg/l, afecta a la concentración de tilosina en ambos tipos de agua, determinándose concentraciones inferiores al 65 % y que en el último punto de control, a 24 h, es de 30-40% -agua blanda y agua dura, respectivamente-.
Para tratamientos de potabilización de 1 mg/l la concentración de tilosina en las 24 horas de estudio se observa estable.
El peróxido de hidrógeno, a dosis altas de 30 mg/l, determina concentraciones de tilosina en agua dura del 94,7% y en agua blanda por encima del 95 %; por lo tanto, se puede considerar estable en las 24 h de contacto.
Para dosificaciones del desinfectante de15 mg/litro la estabilidad de la tilosina está por encima del 96-97 %.
El dióxido de cloro, a sus dos concentraciones 2,5 y 0,45 mg/,l permanece estable en los dos tipos de agua blanda y dura.
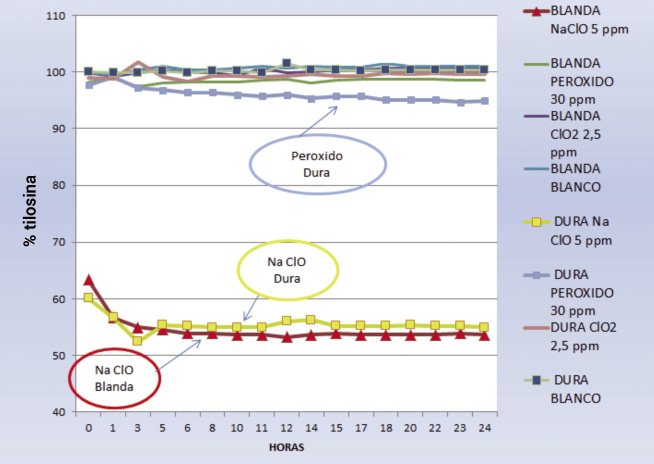
Fig. 2. Estabilidad de la tilosina en presencia de desinfectantes a dosis altas.
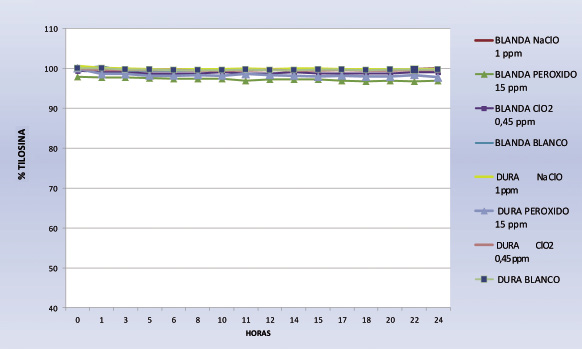
Fig. 3. Estabilidad de la tilosina en presencia de higienizantes. Dosis óptima potabilización.
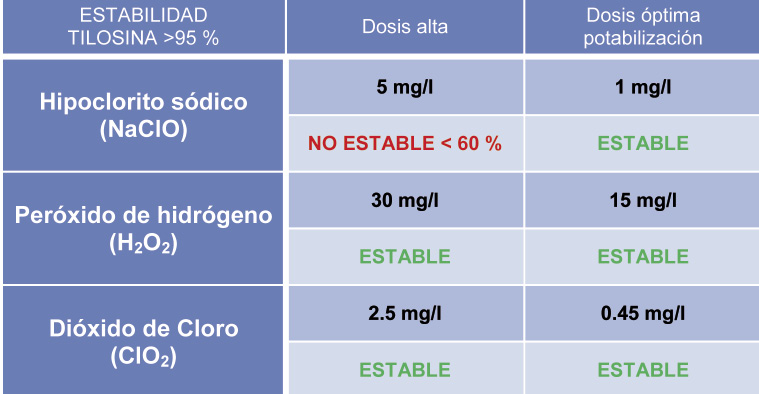
Tabla 4. Estabilidad de la tilosina frente a los desinfectantes.
Resultados con enrofloxacina
Los resultados obtenidos se exponen en las figuras 3 y 4.
- Para las aguas control dura y blanda se observa estabilidad en la concentración de la enrofloxacina.
- Con hipoclorito sódico, a dosis de 5 mg/l, se observa disminución en su estabilidad, dando concentraciones por debajo del 30-40% -agua blanda y dura, respectivamente- en relación a la concentración en aguas control.
En dosis de desinfección de 1 mg/l la enrofloxacina es estable durante las 24 horas estudiadas.
– Con peróxido de hidrógeno, a dosis de 30 mg/ml, las concentraciones de enrofloxacina permanecen estables en general, aunque descienden finalmente hasta el 94,7 % a las 18 h.
A dosis óptimas de 15 mg/ml observaríamos estabilidades superiores al 98 % de doxiciclina.
– Frente a dióxido de cloro, a dosis de 2,5 mg/ml, se observan cuantificaciones de enrofloxacina por debajo del 83 %. Baja estabilidad.
Mientras que en dosis de 0,.45 mg/ml sería estable > 98 %.
Resultados con doxiciclina
Los resultados obtenidos se muestran en las figuras 5 y 6.
- Se observa que la doxiciclina permanece estable durante las 18-21 h del ensayo para agua de control dura y blanda.
- El hipoclorito sódico, a dosis de 5 ppm, desestabiliza la doxiciclina, dejando sus concentraciones nulas en el caso de aguas duras y únicamente al 8 % en las aguas blandas.
Cuando la concentración es la óptima del 1 ppm la estabilidad de la doxiciclina es mayor del 95 %.
- El peróxido de hidrógeno, a dosis de 30 mg/ml, determina la disminución progresiva en la estabilidad de la doxiciclina, que alcanza el 21 % en aguas duras y 31,6 % en las blandas.
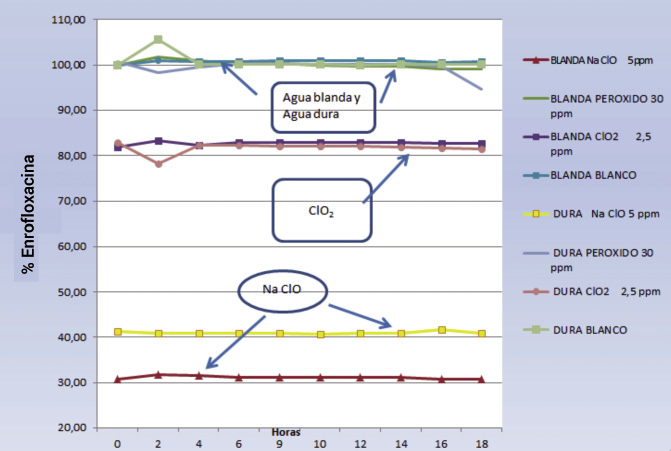
Fig. 4. Estabilidad de la enrofloxacina % en presencia de desinfectantes a dosis altas.
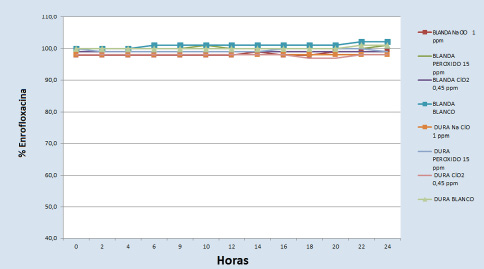
Fig. 5. Estabilidad de la enrofloxacina en presencia de higienizantes a dosis óptima de potabilización.
A dosis optimas de 15 mg/ml se observan descensos en la concentración de doxiciclina que llegan al 77,6 % en aguas duras y 86,6 % en aguas blandas. Por lo tanto, se concluye que no resulta estable.
- El dióxido de cloro, a la dosis alta de 2,5 mg/ml, permanece en general en niveles de estabilidad, siendo sus concentraciones superiores al 97 %.
A dosis óptimas de potabilización de 0.45 mg/ml, se puede considerar estable al dar resultados de concentración del orden del 94%.
En definitiva, la doxiciclina se muestra como una molécula más susceptible a los tratamientos de potabilización, lo que se debe tener en cuenta para que estos, si se realizan, sean a dosis óptimas. Para el hipoclorito sódico utilizar dosis de 0,8-1 ppm donde todavía los niveles de cloro libre son bajos y los efectos oxidativos no son tan importantes. En el caso que los niveles de cloro libre sean altos se pueden utilizar sustancias químicas como el tiosulfato o ácido cítrico capaces de neutralizar el cloro libre presente.
Para la desinfección con peróxidos los mecanismo de oxidación intrínseca de la molécula, así como los de la producción de iones hidroxilos -radicales libres- que incrementan la actividad oxidante de la misma, harían desaconsejable su uso en presencia de doxiciclina.
Recomendaciones
De los resultados obtenidos se pueden inferir algunas recomendaciones:
- Los desinfectantes utilizados para la potabilización del agua en este ensayo son agentes químicos oxidantes capaces de alterar la estabilidad de los antibióticos. Esta circunstancia se debe tener en cuenta a la hora de hacer un tratamiento antibiótico en aguas potabilizadas.
- Como los diferentes desinfectantes no actúan de la misma manera y con la misma intensidad sobre los antibióticos, los laboratorios pueden informar de estas circunstancias.
- No todos los antibióticos son igualmente susceptibles a los desinfectantes, por lo que sería bueno consultar a los fabricantes.
- Será prudente, en el caso de no anular el desinfectante, el optimizar la dosis de potabilización; de esta manera se pueden evitar en muchas ocasiones las pérdidas de actividad de los antibióticos.
- Si se desconoce si el desinfectante puede, o no, afectar al antibiótico, será mejor evitar la potabilización durante los 3-5 días de tratamiento, consiguiendo de esta manera asegurar la integridad de la molécula y por lo tanto su actividad y los resultados terapéuticos esperados. •
Tabla 1. Principios activos contemplados y dosis.
|
Principio activo |
Presencia teórica antibiótico en agua |
|
Tilosina (tartrato) |
Tilosina 500 mg/litro |
|
Doxiciclina (hiclato) |
Doxiciclina 100 mg/litro |
|
Enrofloxacina |
Enrofloxacina 100 mg/litro |
Tabla 2. Desinfectantes utilizados.
|
Desinfectantes comerciales |
1er ensayo Dosis de desinfección |
2º ensayo Dosis de potabilización |
|
Hipoclorito sódico |
5 mg/l (Cloro libre) |
1 mg/l (Cloro libre) |
|
Peróxidos a 50 % |
30 mg/l de H2O2 |
15 mg/l de H2O2 |
|
Dióxido de cloro |
2,5 mg/ICIO2 |
0,45 mg/l CIO2 |
Tabla 3. Características de las aguas empleadas en los ensayos.
|
Ensayos |
1º (Septiembre 2013) |
2º (febrero 2014) |
||
|
Tipo de aguas |
Blanda (comercial) |
Dura (Tarragona) |
Blanda (A Coruña) |
Dura (Castellón) |
|
Conductividad mS/cm |
289 |
1.310 |
452 |
524 |
|
Dureza CaCO3 mg/l |
160 |
535 |
160 |
320 |
|
pH |
7,69 |
7,92 |
7,02 |
7,9 |
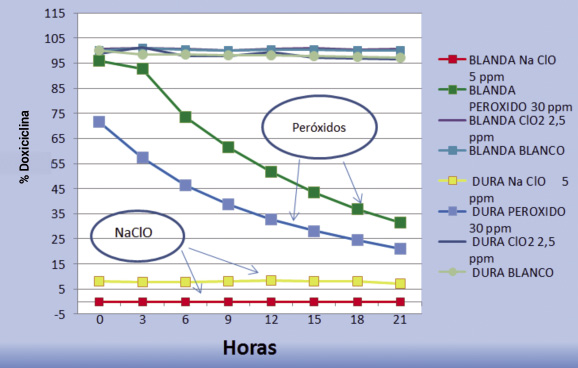
Fig. 6. Estabilidad de la doxiciclina en presencia de desinfectantes a dosis altas.
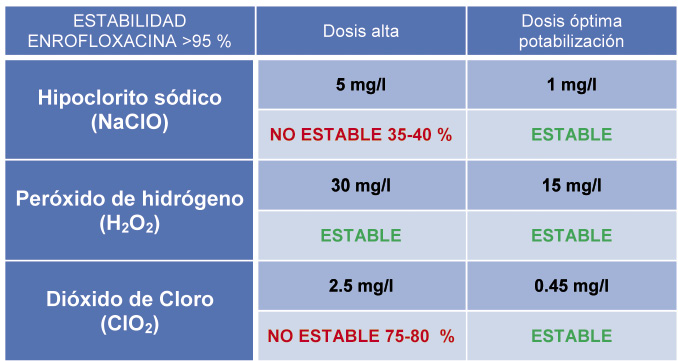
Tabla 5. Estabilidad de la enrofloxacina frente a los desinfectantes.

Fig. 7. Doxiciclina % en presencia de higienizantes. Dosis óptima de potabilización.

Tabla 6. Estabilidad de la doxiciclina frente a los desinfectantes.
Con el apoyo de:

Categorías

Chore-Time
Leer
Vaxxitek HVT+IBD
Leer
Thermorizer TR
Leer
SANOVO presenta su nueva clasificadora de huevos STAALKAT de 108.000 huevos / hora
Leer
Naves ganaderas, almacenes y cobertizos
Leer
Paneles de plástico
Leer
 Revistas
Revistas Archivo
Archivo La revista de la industria
La revista de la industria











































 PDF
PDF