Este artículo es parte de la edición de enero, 2014
MANEJO DE LA MICROFLORA DE LA GALLINA PONEDORA
Marta Revuelta Gutiérrez
Responsable técnico-comercial de monogástricos. Lallemand BIO S.L.
[email protected]
Hoy en día, el sector avícola es uno de los sectores más tecnificados y con los mejores rendimientos productivos en el ámbito de la producción animal. Los niveles de control de los parámetros productivos son elevadísimos y el productor conoce en todo momento qué es lo que está produciendo y a qué coste. Un aspecto a menudo no considerado en la producción avícola y que puede influir significativamente sobre los resultados productivos es la salud de la microflora intestinal. Este no es un parámetro fácil de controlar o evaluar. Este artículo pretende ser una aproximación a este parámetro, con el objetivo de ofrecer algo de información y algunas herramientas para abordar este tema.
Artículo patrocinado por Lallemand
Entender la microflora de las aves y su evolución
El tracto gastrointestinal -TGI- es un ecosistema dinámico que contiene una comunidad microbiana compleja -Rehman y col., 2007- y generalmente es aceptado que esta microflora intestinal tiene un impacto sobre el crecimiento y la salud de las aves -Knarreborg y col., 2002-. El buen manejo de la microflora intestinal es un factor clave para asegurar una buena salud, bienestar y la seguridad microbiana de las aves y sus productos.
Por otro lado, los microorganismos del tracto digestivo son excretados en las heces y colonizan el ambiente. Como consecuencia, la microflora de los animales y su entorno están en constante interacción, y esta relación puede influir en los resultados zootécnicos de las aves. De hecho, es fundamental la comprensión y el monitoreo de estos ecosistemas microbianos.
Es bien conocido que la población microbiana del tracto digestivo de las aves evoluciona con la edad -Hume y col., 2003, Rehman y col. 2007, Lu y col. 2003- y cada región del TGI desarrolla una comunidad bacteriana específica -Lu y col., 2003-.
En pollitos jóvenes, el intestino es colonizado rápidamente por Coliformes, Estreptococcos y Clostridios, y a los 3 días de vida se identifican los primeros Lactobacilos. En unas 2 semanas se establece una típica microflora en el intestino delgado, aunque la flora cecal tardará hasta 30 días en desarrollarse completamente. En el ciego predominaran Bifidobacterias y Bacteriodes aunque pueden aislarse especies patógenas como Salmonella, Campilobacter y E.coli -Amit-Romach y col., 2004-.
Los Lactobacilos se establecen en el buche de las aves, inoculan la digesta y están presentes a lo largo de todo el TGI, aunque en ciertas regiones se instala de forma predominante, como en el íleo -Tannock, 2004-. En trabajos de campo, realizados por Lallemand, se identificaron concentraciones importantes de bacterias ácido lácticas -BAL- en la materia fecal de gallinas ponedoras y se observó un incremento de estas poblaciones de BAL con el incremento de la edad de las gallinas ponedoras -P<0,1, no publicado-.
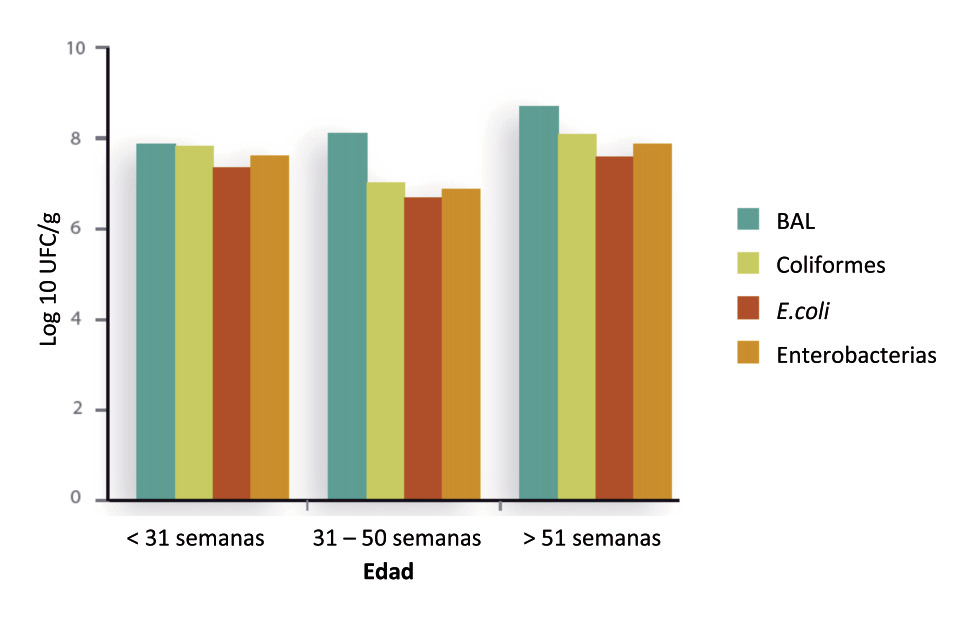
Fig. 1. Influencia de la edad sobre el perfil microbiano en gallinas ponedora de una explotación comercial (n=43) (Investigación interna de Lallemand).
Descripción de la microflora intestinal de las aves
Los microorganismos de la flora digestiva pueden estar localizados en el lumen intestinal, enterrados en la capa de mucus o adheridos a la mucosa digestiva, donde pueden formar capas de células muy importantes. Teniendo en cuenta el espesor de la capa de mucosa (100 – 200 micrones) y el tamaño tan pequeño de una bacteria (0,1 a 6- 10 μm), es posible observar una acumulación de bacterias de gran actividad. También es importante la localización para que ocurra una interacción entre la bacteria y la mucosa intestinal -Gabriel y col. 2003-. Esta interacción es la base para algunos “fenómenos” muy importantes como el “eje Intestino-cerebro” que describe el efecto directo de ciertas bacterias sobre ciertas partes muy específicas del cerebro. Los investigadores han reconocido desde hace mucho tiempo el vínculo entre las funciones gastrointestinales y el sistema nervioso central -eje intestino-cerebro- y los microorganismos intestinales han sido identificados como claves en esta comunicación intestino-cerebro -Berrick y col., 2012-.
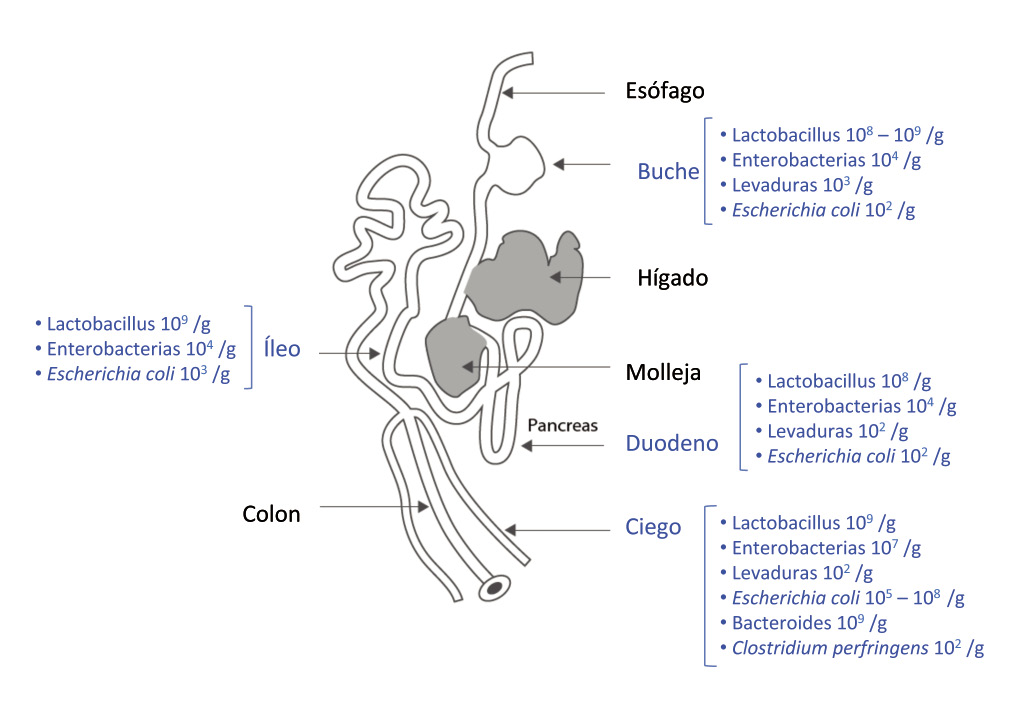
Fig. 2. La microflora en diferentes partes del tracto gastrointestinal (Gabriel y col., 2005).
La flora luminal depende de la disponibilidad de nutrientes, de la velocidad de tránsito y de la presencia (o ausencia) de sustancias antimicrobianas. La flora de la mucosa también depende de la expresión del huésped para los sitios específicos de adhesión en los enterocitos, la velocidad de producción de mucus, de la producción de anticuerpos y de la extrusión de las membranas celulares -Fuller, 1989; Gabriel y col., 2005-.
1. Composición de la microflora intestinal
Desde un punto de vista microbiológico, el intestino y su microflora de pueden describir de dos formas. Una primera forma se puede categorizar acorde a la localización de la microflora a lo largo del tracto gastrointestinal -Adil and Magray, 2012-. La flora digestiva varía su composición a lo largo del TGI del ave, dónde podemos destacar 3 fracciones más importantes a nivel concentraciones microbianas: intestino delgado, ciegos e Intestino grueso.
La mayor parte de la microflora digestiva se localiza en el buche y en los ciegos, pero también en menor número, a lo largo del intestino delgado (< 108/g) -Jouglar, 2002-. En la parte superior del tracto digestivo, dominan los anaerobios facultativos, mientras que en los ciegos están presentes principalmente los anaerobios estrictos. La microflora dependerá de numerosos factores tales como el individuo, la edad, el entorno y la dieta -Gabriel y col., 2005; Adil y Magray, 2012-.
Una segunda forma de describir la microflora es teniendo en cuenta la dominancia de los microorganismos. En esta clasificación, podemos diferenciar 3 grupos:
- Flora dominante (90 %; > 107 UFC/g) compuesta por especies anaerobias estrictas; Bifidobacterias, Lactobacilos y Enterobacterias.
- Flora subdominante (1 %; 105 a 107 UFC/g) que contiene E.coli, Enterococos y Estreptococos.
- Flora fluctuante (0,01 %; < 105 UFC/g) generalmente compuesta de bacterias anaerobias estrictas, potencialmente patógenas -Clostridium, Proteus-, Jouglar, 2002.
2. Factores que afectan la microflora
Existen diversos factores que pueden alterar la microbiota intestinal. Por ejemplo, las especies de Lactobacilos y Bifidobacterias parecen ser sensibles al estrés, y esta población tiende a disminuir cuando el animal se encuentra bajo estrés -Patterson and Burkholder, 2003-.
Entre los factores a destacar que pueden modificar la microflora están el alimento, el entorno, los antibióticos, las vacunaciones y los probióticos. La flora digestiva depende directamente del alimento, ya que éste es el origen del sustrato disponible para el crecimiento de los microorganismos, y puede verse alterada por el tipo de cereal utilizado, especialmente por la presencia de polisacáridos no amiláceos solubles en agua -Mathlouti, y col., 2002-, así como por la forma en que estos cereales son presentados. Las comunidades bacterianas también son afectadas por los niveles y el tipo de nutrientes, como el nivel de grasa -Gabriel y col., 2003-, el tipo de azúcares -Weurding, 2002- y la estructura física del alimento. Los ácidos grasos de cadena corta -AGCC- y otros productos metabólicos se verán afectados por la formulación de la dieta y por la edad del animal -Rehman y col., 2007; Gabriel, 2005-.
Respecto al entorno, el estrés térmico favorece el desarrollo de bacterias perjudiciales en detrimento de las bacterias beneficiosas; las bacterias aerobias como Estafilococcus, Estreptococcus, Corynebacterium, y Enterobacteriáceas aumentan a lo largo de todo el intestino, mientras que los Lactobacilos disminuyen de forma severa bajo condiciones de estrés -Suzuki y col., 1989-.
La administración de antibióticos también influirá en la microflora. El cambio de la composición de la microflora inducido por las terapias con antibióticos es rápido y bastante dramático -Videnska y col., 2013-. Además de reducir los niveles de patógenos, también se disminuyen las poblaciones de bacterias beneficiosas como los Lactobacilos. En una prueba realizada por Lallemand con gallinas camperas, tras el tratamiento con colistina durante 5 días a 56 semanas edad- se redujeron los niveles de patógenos potenciales en heces pero a los 11 días postratamiento, los niveles de Coliformes, Enterobacterias y E.coli se habían incrementado en 2 logs.
Por otro lado, existen estudios que sugieren que la microflora de los ciegos de las aves está en riesgo cuando los animales experimentan un estrés inmunológico como el ligado a una vacunación. El estrés inmunológico puede romper la homeostasis de la microflora cecal y alterar las funciones inmunes de la mucosa intestinal -Yang y col., 2011.
Por último, un factor a considerar es la suplementación con un probiótico, un microorganismo vivo que pueda tener un efecto positivo sobre la composición de la microflora, ayudando a mantener el equilibrio y a responder frente a los factores que puedan alterar puntualmente la composición de la microflora de la ave.
Evaluación de la microflora en la granja
Se ha observado que existe una elevada prevalencia de E.coli asociada a la mortalidad de las gallinas, por ello es de gran importancia monitorizar la evolución de la población microbiana con el objetivo de prevenir disbiosis que puedan a su vez producir un descenso de los resultados zootécnicos.
Tabla 1. Evolución de la microflora fecal después de un tratamiento antibiótico (*)
|
|
Lactobacilos |
Coliformes totales |
Enterobacterias Totales |
E. coli |
|
|
Nave |
8,00E+07 |
2,00E+06 |
5,00E+06 |
9,00E+05 |
Con Colistina |
|
Exterior |
5,00E+07 |
1,00E+07 |
1,00E+07 |
2,00E+06 |
|
|
Nave |
7,65E+08 |
1,91E+08 |
1,30E+08 |
4,54E+07 |
11 días después del tratamiento con colistina |
|
Exterior |
1,34E+10 |
9,09E+08 |
1,56E+09 |
9,82E+08 |
La evaluación de la población bacteriana fecal es una buena herramienta para hacernos una idea de estado sanitario y del riesgo de infecciones de una granja en un momento concreto. Además, esta técnica nos puede permitir evaluar cambios en la alimentación que se puedan realizar, como el añadir un probiótico para estabilizar la microflora intestinal o ver el efecto de ciertas medicaciones sobre la estabilidad de la microflora.
Para realizar los análisis microbiológicos es preciso recoger muestras de heces en la granja. En el momento de la recogida de muestras, podemos distinguir entre dos tipos de heces:
- Intestinal: provienen del recto, son heces con un color más verdoso y presentan una capa blanca de ácido úrico.
- Cecal: son heces que provienen del ciego y son más bien pastosas, algo más húmedas y brillantes, y de color marrón oscuro.
En el momento de la recolección de muestras se deben seguir una serie de pasos y recomendaciones. Es importante recoger siempre muestras de heces frescas. En el caso de granjas de gallinas camperas se deben recoger las muestras directamente del suelo. Cuando se trata de granjas con jaulas, se recomienda poner en marcha las cintas transportados de heces e ir recogiendo las muestras al final de la cinta, a medida que va avanzando. En el caso de que no sea fácil identificar las heces frescas más recientes, es recomendable colocar una superficie plana en el suelo o en la cinta, y esperar a que las gallinas excreten para asegurarnos que son heces frescas.
Es importante no olvidar cambiarse de guantes cada vez que se cambia de nave, para evitar así contaminaciones cruzadas de las muestras.

Fig. 3. Fotografías de diferentes tipos de heces; de izquierda a derecha, heces intestinales, heces intestinales con una capa de ácido úrico y heces cecales.
Representatividad del muestreo
Para conseguir muestras representativas de una nave se han de recolectar un gran número de muestras del mayor número de puntos posibles. Son necesarias, como mínimo, 15 muestras por análisis que deben colocarse en un mismo recipiente -Fig. 4-. Dentro de las muestras para un mismo análisis, se deben recoger tanto muestras de heces cecales como intestinales. Por supuesto, no es necesario recoger para una muestra la totalidad de la deyección, pues con una porción de la misma será suficiente. Para obtener unos buenos resultados se debe dar prioridad a la diversificación de las muestras, es decir, recoger pequeñas cantidades de un número elevado de heces, en lugar de muestras grandes de pocas heces.
Frescura de las deyecciones
La evolución de las poblaciones bacterianas en los excrementos almacenados durante varios días muestra que las diferentes especies bacterianas no se desarrollan a una misma velocidad -Tabla 2-.
Es fundamental, como se ha comentado con anterioridad, que las muestras sean lo más recientes posible y llevar todas las muestras al laboratorio lo más rápido posible, para que puedan ser preparadas y se realicen las siembras en placa en el mismo día.
En el caso de que no pudieran ser analizadas en el mismo día de recolección, las muestras pueden ser almacenadas en ambiente fresco a 4ºC, hasta un máximo de 24 horas. Las muestras nunca deben congelarse. En el envío de las muestras al laboratorio es importante entregarlas con las máximas referencias -fecha, especie, tipo de producción e indicar si se realizan tratamientos como antibióticos, aditivos, etc.-.
Los análisis recomendados a realizar son:
- Bacterias coliformes totales.
- E.coli o coliformes fecales.
- Enterobacteria totales.
- Lactobacilos.
- Bacterias anaerobios sulfito-reductores (ASR).
Además, se recomienda analizar y validar el método de recuento utilizado por el laboratorio, consultar si disponen de un plan de recepción de muestras para su análisis inmediato y ser suficientemente previsor para llevar material suficiente que nos permita recoger todas las muestras necesarias en un mismo día.
En el momento de la evaluación de los resultados es importante tener en cuenta que existirán diferencias sustanciales entre explotaciones y que es recomendable comparar, siempre que sea posible, lotes simultáneos de aves que se encuentren en las mismas condiciones. Otra lectura a realizar, como se ha comentado anteriormente, es observar la evolución de la microflora en un mismo lote con el objetivo de identificar factores de riesgo, parámetros que puedan influenciar negativamente en los crecimientos o para evaluar cambios que realicemos a nivel de manejo, alimentación,…
Resumen y conclusiones
Conocer el estado sanitario de la microflora intestinal de las aves puede ser un factor clave mejorar aún más los niveles de control en la granja y maximizar los resultados de todos los lotes. La microflora intestinal es un ecosistema en equilibrio, pero muy sensible a cualquier variación importante que se produzca en el ave. Evaluar el perfil microbiano de las aves nos puede ayudar a hacernos una idea de cuál es el estado sanitario a nivel digestivo de nuestras aves.
Se ha demostrado que el análisis del perfil microbiano de las heces recogidas en la granja, siguiendo el protocolo presentado, puede ser de gran utilidad para monitorizar este parámetro, que nos dará mucha información sobre el estado de las aves y nos puede permitir evaluar variaciones que podamos realizar a nivel de manejo o de alimentación, como el empleo de una nueva materia, una medicación, vacunaciones o la adición de un aditivo. •
(*) Investigación interna de Lallemand
Tabla 2. Desarrollo de la población de bacterias fecales en gallinas ponedoras en una granja comercial con sistema de jaulas.
|
Numeración del recuento de colonias |
Análisis del día de recogida de las muestras |
Análisis después de tres días a temperatura de la sala |
Desarrollo |
|
Bacterias ácido-lácticas mesofílicas/g (medio MRS) |
120 billones |
1,2 billones |
x 10 |
|
Bacterias coliformes/g (medio VRBL) |
3,6 millones |
2,9 billones |
x 800 |
|
Enterobacterias/g (medio VRBG) |
3,7 millones |
3,6 billones |
x 1.000 |
|
E. coli/g (medio TBX) |
730.000 |
1,1 billones |
x 1.500 |

Fig. 4. Recipiente de plástico relleno de muestras de heces.

Fig. 5. Recolección de muestras frescas de heces.
Con el apoyo de:

Categorías

AgroSupply
Leer
Cosma
Leer
Ingenieria Avicola
Leer
GandAgro
Leer
Availa ZN
Leer
Ross
Leer
 Revistas
Revistas Archivo
Archivo La revista de la industria
La revista de la industria











































 PDF
PDF