Este artículo es parte de la edición de enero, 2013
Salmonella Typhimurium monofásica – Eficacia de la vacunación
Zekaria D.(1), Philipp HC. (1), van Immerseel F. (2), Ducatelle R (2)
1. Lohmann Animal Health
2. Departamento de Patología, Facultad de Veterinaria, Universidad de Gante, Bélgica
[email protected]
Desde mediados de los 90 se han publicado numerosos informes en varios países europeos, así como en EE.UU. y otros, sobre el aislamiento de cepas de Salmonella, similares a S. Typhimurium salvo una diferencia en el antígeno flagelar -EFSA Journal, 2010; Andrea y col., 2008-. Como es sabido, la determinación del serotipo de las Salmonellas se basa en la variabilidad antigénica del LPS – Antígeno O -, flagelo – Antígeno H – y cápsula – Antígeno VI -. La mayoría de las cepas de Salmonella son móviles mediante flagelos. Los flagelos son codificados por un par de genes -fljB, fljC-, cuya expresión está regulada por un mecanismo denominado “Variación de Fase”. La mayoría de las cepas expresan ambas fases y por ello son denominadas “bifásicas” -Heather y col., 2003-. En las cepas de S. Typhimurium el antígeno H tiene 2 fases, una llamada “i” y la segunda “1,2”. Las cepas que demuestran estructura antigénica similar a la de S. Typhimurium, pero sin expresar ciertos antígenos flagelares, se denominan ‘Salmonella Typhimurium like strains’.
El serotipo S. Typhimurium 1,4,[5],12:i:- y el S. Typhimurium 1,4,[5],12:i:1,2 tienen las mismas determinantes antigénicas O y Hi; sin embargo, en la cepa 1,4,[5],12:i:- falta la fase 2 flagelar y por ello se denomina “S. Typhimurium monofásica”. Se han aislado también cepas que no presentan la fase 1 (1,4,[5],12:-:1,2) o ambas fases (1,4,[5],12:-:-), pero parece que no están relacionadas con enfermedad en animales o el hombre. Según parece, la cepa 1,4,[5],12:i:- “ha tenido éxito” conquistando nichos ecológicos, ya que estudios recientes en varios países alrededor del mundo confirman la aparición y la diseminación rápida de la misma. Actualmente, la cepa 1,4,[5],12:i:- se encuentra entre los 10 serotipos más comunes asociados con la enfermedad en humanos en varios países. Según el sistema de alerta europeo, la cepa 1,4,[5],12:i:- fue la 4ª en prevalencia en humanos en el 2006, habiéndose informado de brotes en humanos también en EE.UU., España, Brasil y otros países – Andrea y col., 2008 -. El último brote en EE.UU. afectó a 272 personas -CDC 2007 c-. La mayoría de los aislamientos en animales y el alimento provienen del porcino y vacuno, aunque se ha informado sobre numerosos casos cuyo origen es la avicultura. Las cepas de 1,4,[5],12:i:- parece tener una virulencia y patrón de resistencia a los antibióticos similar a otras cepas de S. Typhimurium. Según Hauser y col. -2010-, la mayoría de los aislamientos europeos de S. Typhimurium 1,4,[5],12:i:- demuestran resistencia a un número amplio de antibióticos -Multi-Drug-Resistance: MDR-.
La detección de Salmonella en muestras de alimentos y en la producción primaria en el sistema de vigilancia europeo se realiza siguiendo el protocolo -ISO 6579 y Anexo D-, en el cual se usa el medio de cultivo MSRV. En principio, es posible detectar la cepa 1,4,[5],12:i:- en este medio de cultivo. Sin embargo, ya que la identificación serológica de esta cepa es distinta, puede que los protocolos de identificación no se hubieran hecho siguiendo el mismo criterio en los diferentes Estados Miembros. Es posible que, debido a la ausencia de procedimientos de tipaje e informe armonizados, la prevalencia real sea mayor a la indicada. Hoy en día, es aconsejable proceder con el serotipaje hasta llegar al primer resultado negativo de aglutinación después de la inversión de la fase flagelar y entonces proceder a PCR para poder confirmar la ausencia de la 2ª fase flagelar.
Las vacunas vivas atenuadas derivadas de S. Typhimurium se usan habitualmente y su eficacia, facilidad de uso y seguridad están probadas en condiciones de campo desde hace años. La S. Typhimurium cepa Nal 2/Rif 9/Rtt se usa con éxito prácticamente en todo el mundo para la prevención de las infecciones por S. Typhimurium en avicultura como componente de AviPro® Salmonella Vac T y AviPro® Salmonella Duo. Sin embargo, la protección contra el serotipo 1, 4,[5],12:i:- no ha sido estudiada anteriormente. La eficacia de la vacunación con S. Typhimurium cepa Nal 2/Rif 9/Rtt en pollitas fue estudiada realizando una exposición con una cepa de campo de S. Typhimurium monofásica a los 14 días de vida.
El estudio se desarrolló vacunando 30 pollitas de una estirpe de puesta el primer día de vida. Un grupo control fue constituido por 30 pollitas que se dejaron sin vacunar. A los 14 días de vida se expuso ma las aves con 9,1 x 108 Unidades Forma-doras de Colonias -UFC- de S. Typhimurium monofásica aplicada al buche. 14 días después de la exposición se cuantificó la presencia de la cepa en los ciegos y bazo de 10 pollitas de cada grupo. Así también, a los 3, 6 y 11 días post infección se recogieron hisopos cloacales de todas las aves y se procedió al aislamiento de la cepa usada en la exposición.
Tal como se puede apreciar en los gráficos adjuntos, la excreción de la cepa de campo de exposición de S. Typhimurium monofásica fue reducida significati-vamente en las aves vacunadas en comparación con las aves no vacunadas. Así también se pudo demostrar que la presencia de la cepa de exposición en el bazo y ciegos fue reducida en las aves vacunadas.
Se puede concluir que en el caso de infección con S. Typhimurium monofásica la inmunización con la cepa de la misma Nal 2/Rif 9/Rtt usada en AviPro® Salmonella Vac T y AviPro® Salmonella Vac Duo origina una reducción considerable en la excreción del patógeno. Así también, la colonización del ciego se reduce sustancialmente.
Algunos estudios europeos relacionan las infecciones humanas con S. Typhimurium monofásica al cerdo y sus productos, siendo factible suponer que el uso extensivo de la vacunación en europa en los últimos años evitó una incidencia mayor en las aves.
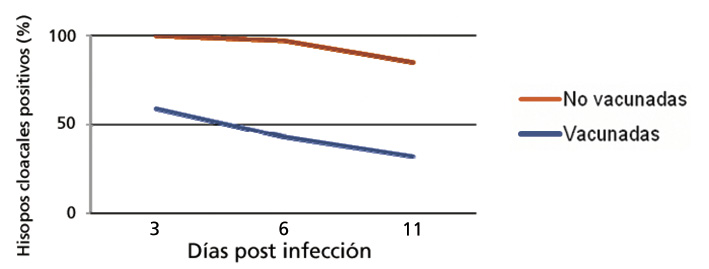
Fig. 1. Excreción de la cepa de exposición
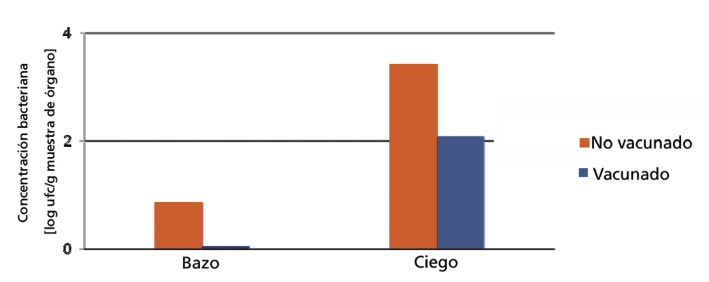
Fig. 2. Determinación cuantitativa de la cepa de exposición en ciegos y bazos 14 días post infección.
Con el apoyo de:

Categorías

Figan
Leer
Chore-Time
Leer
Big Dutchman
Leer
New Farms
Leer
Merial – Vaxxitek
Leer
Hubbard H1
Leer
 Revistas
Revistas Archivo
Archivo La revista de la industria
La revista de la industria










































 PDF
PDF